|
تضامنًا مع حق الشعب الفلسطيني |
عدم الانفصال
عدم الانفصال (بالإنجليزية: Nondisjunction)[1] هو فشل الكروموسومات المتماثلة أو الكروماتيدات الشقيقة في الانفصال بشكل صحيح أثناء انقسام الخلية. هناك ثلاثة أشكال من عدم الانفصال: فشل زوج من الكروموسومات المتماثلة في الانفصال أثناء الانقسام الميوزي I، وفشل الكروماتيدات الشقيقة في الانفصال أثناء الانقسام الميوزي II، وفشل الكروماتيدات الشقيقة في الانفصال أثناء الانقسام المتساوي (الانقسام الميتوزي).[2][3][4] يمكن الإشارة إلى هذه الأنواع من عدم الانفصال بعدم الانفصال الميوزي الأول وعدم الانفصال الميوزي الثاني وعدم الانفصال الميتوزي، على التوالي. ينتج عن عدم الانفصال خلايا ابنة ذات عدد غير طبيعي من الكروموسومات (اختلال الصيغة الصبغية).[5]
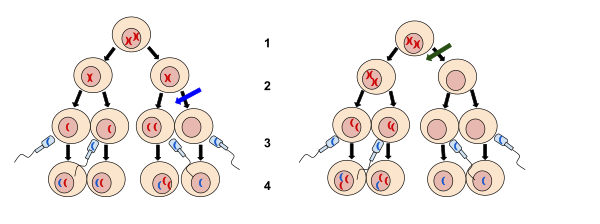
يُنسب اكتشاف عدم الانفصال في الكروموسومات الجنسية عند ذبابة الفاكهة السوداء إلى كالفين بريدجز وتوماس هانت مورغان في ربيع عام 1913،[تحقق من المصدر]أثناء العمل في مختبر علم الحيوان بجامعة كولومبيا.[6][7][8]
الأنواع
بشكل عام، يمكن أن يحدث عدم الانفصال في أي شكل من أشكال الانقسام الخلوي الذي يتضمن التوزيع المنظم للمادة الصبغية. الحيوانات العليا لديها ثلاثة أشكال مميزة من هذه الانقسامات الخلوية: الانقسام الميوزي الأول والانقسام الميوزي الثاني هما شكلان متخصصان من الانقسام الخلوي يحدث أثناء توليد الجاميت (البويضات والحيوانات المنوية) للتكاثر الجنسي، والانقسام الميتوزي هو شكل الانقسام الخلوي الذي تستخدمه جميع الخلايا الأخرى في الجسم.
الانقسام الميتوزي
يسبق انقسام الخلايا الجسدية (انقسام ميتوزي) تضاعف المادة الوراثية في المرحلة S (طالع صفحة الطور البيني). نتيجةً لذلك، يصبح كل كروموسوم عبارة من كروماتيدين شقيقين متماسكتين معًا في منطقة السنترومير. أثناء طور الانفصال الميتوزي، تنفصل الكروماتيدات الشقيقة وتهاجر إلى أقطاب الخلية المعاكسة قبل انقسام الخلية. يؤدي عدم الانفصال أثناء هذه المرحلة الحاسمة إلى تلقي ابنة واحدة للكروماتيدات الشقيقة للكروموسوم المصاب بينما لا تحصل الأخرى على أي كروماتيدات.[3][4] يُعرف هذا باسم جسر الكروماتين أو جسر طور الانفصال. ينتج عن عدم الانفصال الميتوزي الفسيفساء الجسدية، حيث أن الخلايا الوليدة فقط التي تنشأ من الخلية التي حدث فيها عدم الانفصال سيكون لها عدد غير طبيعي من الكروموسومات.[3] يمكن أن يساهم عدم الانفصال أثناء الانقسام الميتوزي في تطور بعض أشكال السرطان، على سبيل المثال الورم الأرومي الشبكي (طالع الرسم البياني التوضيحي أدناه).[9] يمكن أن يُعزى عدم انفصال الكروموسوم في الانقسام الميتوزي إلى تعطيل نشاط توبويزوميراز II، أو كوندينسين، أو سيباريز (Separase).[10] تمت دراسة عدم الانفصال الميتوزي جيدًا في السكيراء الجعوية. تخضع هذه الخميرة للانقسام على غرار حقيقيات النوى الأخرى.[11] تحدث جسور الكروموسوم عندما يتم تجميع الكروماتيدات الشقيقة معًا بعد تضاعف الدنا بواسطة التشابك الطوبولوجي للحمض النووي DNA ومركب التماسك المدعو كوهيسين (cohesin). أثناء طور الانفصال، يتم شق الكوهيسين بواسطة إنزيم السيباريز.[12] التوبويزوميراز II، أو كوندينسين هما المسؤولان عن إزالة السلسلية.
الانقسام الميوزي I
يحدث عدم الانفصال أثناء الطور الانفصالي (طور الصعود)، عندما لا ينفصل زوج من الكروموسومات المتماثلة قبل أن يتم توزيعهما في خليتين ابنتين. في الخلايا الناتجة، تحتوي إحدى الخلايا على نسختين من الكروموسوم المتماثل، بينما لا تحتوي الخلية الأخرى على أي نسخة. عندما تنقسم كل واحدة من هذه الخلايا إلى خليتين خلال الانقسام الميوزي الثاني، فإن الخلايا الأربعة المنتجة ستصاب جميعها بتشوهات صبغية.[5]
الانقسام الميوزي II
يتم إيقاف البويضات المباضة في الانقسام الميوزي الثاني قبل بدأ التخصيب. يؤدي التخصيب فيما بعد إلى بدأ الانقسام الميوزي الثاني. على غرار أحداث الفصل في الانقسام الميتوزي، يتم فصل أزواج الكروماتيدات الشقيقة في الطور الانفصالي الثاني أثناء الانقسام الميوزي الثاني. هذه الكروماتيدات الشقيقة ناتجة عن فصل الكروموسومات المتثماثلة (ثنائي التكافؤ) في الطور الانفصالي الأول الذي قد حدث أثناء الانقسام الميوزي الأول.
من المهم ملاحظة الفرق بين الكروماتيدات الشقيقة في الانقسام الميتوزي والكروماتيدات الشقيقة في الانقسام الميوزي الثاني. الفرق الأساسي هو أنه في الانقسام الميتوزي، تكون الكروماتيدات الشقيقة متطابقة جينياً بسبب تضاعف المادة الجينية قبل بدأ عملية الانقسام في المرحلة S(طالع صفحة الطور البيني). في المقابل، لا تكون الكروماتيدات الشقيقة متطابقة جينياً في الانقسام الميوزي الثاني، وذلك بسبب التعابر الكروموسومي الذي قد حدث في الانقسام الميوزي الأول.
في البويضات، يتم فصل الكروماتيد الشقيق وتوزيعه إلى الجسم القطبي الثاني، بينما يبقى الكروماتيد الآخر داخل البويضة. أثناء تكوين الحيوانات المنوية، يكون كل انقسام ميوزي نموذجي، بحيث تؤدي كل خلية منوية أولية إلى ظهور خليتين منويتين ثانويتين بعد الانقسام الميوزي الأول، وفي النهاية 4 حيوانات منوية بعد الانقسام الميوزي الثاني. يؤدي عدم الانفصال الميوزي الثاني (II) أيضًا إلى متلازمات اختلال الصيغة الصبغية، ولكن بدرجة أقل بكثير من حالات عدم الانفصال الميوزي الأول (I).[13]

الآليات الجزيئية
الدور المركزي لنقطة تفتيش تجمع المغزل
نقطة تفتيش تجمع المغزل (SAC) هي آلية حماية جزيئية تتحكم بالفصل الصحيح للكروموسوم في الخلايا حقيقية النواة. يمنع SAC تقدم طور الانفصال حتى تتم محاذاة وترصيف جميع الكروموسومات المتماثلة (ثنائية التكافؤ في الانقسام الميوزي الأول) والكروماتيدات الشقيقة (في الانقسام الميوزي الثاني والانقسام الميتوزي) بشكل صحيح مع جهاز المغزل. عند تحقق ذلك فقط، تقوم SAC بتثبيط المركب والمعقد المعزز لطور الانفصال (APC)، والذي يؤدي بدوره إلى حدوث الطور الانفصالي.
الاختلافات الخاصة بالجنس في الانقسام الميوزي
أظهرت الدراسات الاستقصائية لحالات متلازمات اختلال الصيغة الصبغية أن معظمها مشتق من الأم.
هذا يثير السؤال: لماذا يكون الانقسام الميوزي الأنثوي أكثر عرضة للخطأ؟ يتمثل الاختلاف الأكثر وضوحًا بين تكون البويضات عند الإناث وتكون الحيوانات المنوية عند الذكور في التوقيف المطول للبويضات في المراحل المتأخرة من الطور التمهيدي الأول لسنوات عديدة تصل إلى عدة عقود. من ناحية أخرى، تمر الأمشاج الذكرية بسرعة بجميع مراحل الانقسام الميوزي الأول والثاني. إضافةً إلى ذلك، هناك اختلاف مهم آخر بين الانقسام الميوزي للذكور والإناث يتعلق بتكرار إعادة التركيب الجيني بين الكروموسومات المتماثلة: بشكل عام، يحدث إعادة التركيب بنسبة أكبر عند الإناث مقارنةً بالذكور.[14][15][16][17] تم توثيق حالات فشل إعادة التركيب أو عمليات التعابر غير الملائمة كمساهمين في حدوث عدم الانفصال في البشر، بمعنى أنه حدوث اختلال الصيغة الصبغية وعدم الانفصال الميوزي الأنثوي يكون أكثر شيوعاً بسبب زيادة نسبة إعادة التركيب مقارنة بالذكور.
فقدان روابط التماسك (Cohesin) المرتبط بالعمر
بسبب التوقيف المطول للبويضات البشرية في الانقسام الميوزي الأول، فإن ضعف الروابط المتماسكة التي تربط الكروموسومات مع بعضها بالإضافة إلى انخفاض نشاط SAC قد يساهم في حدوث أخطاء في التحكم بفصل الكروموسومات عن بعضها. يرتبط معدل حدوث هذه الأخطاء بعمر الأم.
يعتبر معقد كوهيسن (cohesin) مسؤولاً عن الحفاظ على تماسك الكروماتيدات الشقيقة معًا ويوفر مواقع ربط من أجل ارتباط المغزل. يتم تحميل Cohesin على الكروموسومات المنسوخة حديثًا في البويضات الأولية (oogonia) أثناء نمو الجنين. تتمتع البويضات الناضجة بقدرة محدودة على إعادة تحميل cohesin بعد الانتهاء من المرحلة S. قد يؤدي الإيقاف المطول للبويضات البشرية قبل الانتهاء من الانقسام الميوزي الأول إلى فقد كبير في التماسك بمرور الوقت. يُفترض أن فقدان التماسك يساهم في التعلق غير الصحيح للأنيبيات الحركية ويزيد من أخطاء فصل الكروموسوم أثناء الانقسامات الميوزية.[18]
الآثار
عدم الانفصال هو خطأ عشوائي (على الرغم من وجود بعض العوامل التي تزيد من نسبة حدوثه)، تكون نتيحة هذا الخطأ خلية فيها خلل في عدد الكروموسومات (طالع صفحة اختلال الصيغية الصبغية). ويقال أن هذه الخلية مختلة الصيغة الصبغية. في غالب الأحيان، تموت هذه الخلايا عن طريق الإجهاض مثلاً. ولكن في بعض الحالات، قد تكون قابلة للحياة. اختلال الصيغة الصبغية يمكن أن يحصل للصبغيات الجسمية أو الصبغيات الجنسية.
يُشار إلى فقدان كروموسوم واحد (2n-1)، بحيث يكون للخلية (الخلايا) الوليدة المصابة بالخلل كروموسوم واحد مفقود من أحد الأزواج باسم أحادي الصبغي (monosomy). ويشار إلى الحصول على كروموسوم واحد إضافي، بحيث يكون للخلية (الخلايا) الوليدة المصابة بالخلل كروموسوم واحد إضافي لأحد الأزواج باسم التثلث الصبغي.[3] في حالة تخصيب الأمشاج المختلة الصيغة الصبغية، فقد ينتج عن ذلك عدد من المتلازمات:
أحادي الصبغة
فيما يخص أحادية الصبغة، الحالة الوحيدة المعروفة التي يمكن النجاة منها في البشر هي متلازمة تيرنر، حيث يكون الشخص المصاب أحادي الصبغة للكروموسوم X، أي أنه يوجد كروموسم X واحد (انظر أدناه)، وبالتالي فإن الحالة الوحيدة المعروفة لأحادية الصبغة تكون مرتبطة بالكروموسوم الجنسي (اختلال الصيغة الصبغية للصبغي الجنسي X). عادةً ما تكون أحاديات الصبغة الأخرى مميتة أثناء نمو الجنين المبكر، والبقاء على قيد الحياة ممكن فقط إذا لم تتأثر جميع خلايا الجسم في حالة الفسيفساء (انظر أدناه)، أو إذا تمت استعادة العدد الطبيعي للكروموسومات عن طريق تضاعف الكروموسوم أحادي الصبغة (وهذا ما يمكن تسميته «إنقاذ الكروموسوم»).[4]
متلازمة تيرنر (X monosomy) (45 ، X0)
يمثل الفقد الكامل لكروموسوم X (أي فقدانه بالكامل) حوالي نصف حالات متلازمة تيرنر.[19] يمكننا التشديد على أهمية وجود كل من الكروموسومات X أثناء التطور الجنيني من خلال ملاحظة أن الغالبية العظمى (أكثر من 99٪) من الأجنة مع كروموسوم X واحد فقط (النمط النووي 45 ، X0) يتم إجهاضها تلقائيًا.[20] بكلمات أخرى، يولد حوالي 0.5% فقط من الأجنة التي لديها كروموسوم X واحد فقط (النمط النووي 45 ، X0)، بالإضافة إلى 0.5% من الأجنة التي لديها كروموسوم X واحد وجزء من كروموسم إكس الآخر. هذا يعني أنه يمكن أن تحدث متلازمة تيرنر أيضًا إذا كان أحد الكروموسومات الجنسية مفقودًا جزئيًا أو أعيد ترتيبه بدلاً من أن يكون غائبًا أو مفقوداً بشكل كامل. تعاني بعض النساء المصابات بمتلازمة تيرنر من تغير في الكروموسومات في بعض خلاياهن فقط، وهو ما يُعرف باسم الفسيفساء. يقال إن النساء المصابات بمتلازمة تيرنر التي تسببها فسيفساء الكروموسوم X لديهن متلازمة تيرنر الفسيفسائية.[19]
التثلث الصبغي الجسمي
يشير مصطلح التثلث الصبغي الجسمي إلى وجود كروموسوم آخر في الكروموسومات الجسيمة (غير الكروموسومات الجنسية X و Y) في 3 نسخ بدلاً من العدد الطبيعي 2 في الخلايا الضعفانية الطبيعية.
متلازمة داون (تثلث الصبغي 21)
متلازمة داون، وهي تثلث صبغي للكروموسوم الجسمي 21، هي الاضطراب والاختلال الكروموسومي الأكثر شيوعًا لعدد الكروموسوم في البشر. تنجم غالبية الحالات عن عدم الانفصال أثناء الانقسام الميوزي عند الأم.[4][20] يحدث التثلث الصبغي في 0.3٪ على الأقل من الأطفال حديثي الولادة وحوالي 25٪ من حالات الإجهاض التلقائي. تعتبر السبب الرئيسي لإفساد الحمل وهي السبب الأكثر شيوعًا للتخلف العقلي.[21] من الموثق جيدًا أن عمر الأم المتقدم مرتبط بخطر أكبر بحدوث عدم الانفصال الميوزي الذي يؤدي إلى متلازمة داون. قد يترافق هذا مع الإيقاف الميوزي المطول للبويضات البشرية التي يحتمل أن تستمر لأكثر من أربعة عقود.[22]

متلازمة إدوارد (تثلث الصبغي 18) ومتلازمة باتو (تثلث الصبغي 13)
التثلث الصبغي الجسمي الثاني والثالث الأكثر شيوعاً (المتوافق مع الولادة الحية) هو متلازمة إدوارد (التثلث الصبغي 18) ومتلازمة باتو (التثلث الصبغي 13)، على التوالي. عادة ما يكون التثلث الصبغي الكامل للكروموسومات الأخرى غير قابلة للحياة وتمثل سببًا متكررًا نسبيًا للإجهاض.[2][4] فقط في حالات نادرة من الفسيفساء، قد يدعم وجود خط خلوي طبيعي، بالإضافة إلى خط الخلية ثلاثي الذرات، تطوير تثلث صبغي قابل للحياة للكروموسومات الأخرى.[4] في الخلاصة، يمكن القول بأن الكروموسمات الجمسية 21 (الأكثر شيوعًا) و18، و13(الأقل شيوعاً) هي الكروموسومات الجسمية الوحيدة تقريباً التي يمكن أن يحدث فيها خلل أو اضطراب في عددها، بحيث تؤدي إلى ولادة إنسان قابل للحياة. أما الكروموسومات الجسمية الأخرى، فعلى الرغم من أنه من الممكن حدوث خلل أو اضطراب في عددها ولكنها تؤدي في نهاية المطاف إلى موت الجنين. يمكن عزو ذلك جزئياً إلى حجم وشكل الكروموسومات.[بحاجة لمصدر]
اختلال الصيغة الصبغية للصبغيات الجنسية
اختلال الصيغة الصبغية للصبغيات الجنسية هي الحالات التي تحتوي على عدد غير طبيعي من الصبغيات الجنسية، أي بخلاف XX (أنثى) أو XY (ذكر). بشكل عام، يمكن أيضًا تصنيف أحادي الصبغة X (متلازمة تيرنر، كما ذكرنا أعلاه، انظر قسم أحادي الصبغة) كشكل من أشكال اختلال الصيغة الصبغية للكروموسوم الجنسي.
متلازمة كلاينفيلتر (47 ، XXY)
متلازمة كلاينفيلتر هي أكثر أنواع اختلال الصيغة الصبغية للكروموسوم الجنسي شيوعًا في البشر. يمثل السبب الأكثر شيوعًا لقصور الغدد التناسلية والعقم عند الرجال. تحدث معظم الحالات بسبب أخطاء غير مفصولة في الانقسام الميوزي الأبوي 1. حوالي ثمانين بالمائة من الأفراد المصابين بهذه المتلازمة لديهم كروموسوم X إضافي واحد مما يؤدي إلى النمط النووي XXY. تحتوي الحالات المتبقية إما على عدة كروموسومات جنسية إضافية (48 ، XXXY ، 48 ، XXYY ، 49 ، XXXXY)، أو فسيفساء (46 ، XY / 47 ، XXY) ، أو تشوهات بنيوية في الكروموسومات.[4]
(47,XYY) ذكر XYY
تبلغ نسبة حدوث متلازمة XYY تقريبًا 1 في 800-1000 ولادة ذكور. تظل العديد من الحالات غير مشخصة بسبب مظهرها الطبيعي وخصوبتها وغياب الأعراض الشديدة. عادة ما يكون الكروموسوم Y الإضافي نتيجة لعدم الانفصال أثناء الانقسام الميوزي الأبوي.[4]
(47, XXX)التثلث الصبغي للصبغي X
هو شكل من أشكال اختلال الصيغة الصبغية للكروموسوم الجنسي حيث يكون للإناث ثلاثة بدلاً من اثنين من الكروموسومات X. يتأثر معظم المرضى بشكل طفيف بالأعراض النفسية والجسدية. لاحظت الدراسات التي فحصت أصل كروموسوم X الإضافي أن حوالي 58-63٪ من الحالات كانت ناتجة عن عدم الانفصال في الانقسام الميوزي الأول للأم، و16-18٪ بسبب عدم الانفصال في الانقسام الميوزي الثاني للأم، والحالات المتبقية عن طريق ما بعد اللاقحة، أي عدم الانفصال الميتوزي.[23]
ثنائي الصبغة، أحادي الأب أو الأم.
يشير الانقسام الأحادي الأبوي أو الأموي إلى الحالة التي يتم فيها وراثة كل من الكروموسومات لزوج كروموسوم من نفس الوالد وبالتالي تكون متطابقة. هذه الظاهرة هي على الأرجح نتيجة الحمل الذي بدأ في شكل تثلث صبغي بسبب عدم الانفصال. نظرًا لأن معظم حالات التثلث الصبغي مميتة، فإن الجنين يعيش فقط لأنه يفقد أحد الكروموسومات الثلاثة ويصبح قابل للحياة. يمكن هذه الحالة للكروموسوم 15، على سبيل المثال، في بعض حالات متلازمة برادر ويلي ومتلازمة أنجلمان.[20]
متلازمات الفسيفساء
يمكن أن تحدث متلازمات الفسيفساء بسبب عدم الانفصال الانقسامي في نمو الجنين المبكر. نتيجة لذلك، يتطور الكائن الحي كمزيج من خطوط الخلايا مع اختلاف الصيغة الصبغية (عدد الكروموسومات). قد توجد الفسيفساء في بعض الأنسجة، ولكن ليس في البعض الآخر. قد يكون لدى الأفراد المتأثرين مظهر غير مكتمل أو غير متماثل. تتضمن أمثلة متلازمات الفسيفساء متلازمة باليستر كيليان وسلس الصباغ المنقوص التلون.[20]
الفسيفساء في التحول الخبيث

غالبًا ما ينطوي تطور السرطان على تغييرات متعددة في الجينوم الخلوي (فرضية نودسون). يُعد الورم الأرومي الشبكي البشري مثالاً مدروسًا جيدًا لنوع السرطان حيث يمكن أن يساهم عدم الانفصال الميتوزي في التحول الخبيث: يمكن اكتشاف طفرات الجين RB1، الموجود على الكروموسوم 13 والذي يشفر بروتين الورم الأرومي الشبكي الكابت للورم، عن طريق التحليل الخلوي الوراثي في العديد من حالات الورم الأرومي الشبكي. أحيانًا تكون طفرات موضع RB1 في نسخة واحدة من الكروموسوم 13 مصحوبة بفقدان الصبغي 13 الآخر من النمط البري[24] من خلال عدم الانفصال الميتوزي. من خلال هذا المزيج من الآفات، تفقد الخلايا المصابة تمامًا التعبير عن البروتين العامل الكابت للورم.[25]
التشخيص
التشخيص الوراثي السابق للانغراس
التشخيص الوراثي السابق للانغراس(PGD أو PIGD) هو تقنية تستخدم لتحديد الأجنة الطبيعية وراثياً وهي مفيدة للذين لديهم تاريخ عائلي من الاضطرابات الوراثية. هذا خيار للأشخاص الذين يختارون الإنجاب من خلال الإخصاب في المختبر. يعتبر الPGD صعبًا نظرًا لكونه مضيعة للوقت وله معدلات نجاح لا تقارن إلا بIVF الروتيني.[26]
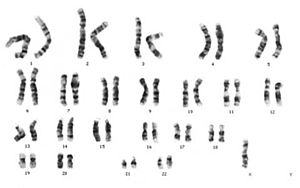
التنميط النووي
يتضمن التنميط النووي إجراء بزل السلى أو فحص الزغابات المشيمية[بحاجة لمصدر]من أجل دراسة خلايا الجنين أثناء الطور الأول. ويمكن استخدام الفحص المجهري الضوئي للكشف البصري عن وجود اختلال الصيغة الصبغية.[27]
تشخيص الجسم القطبي
يمكن استخدام تشخيص الجسم القطبي (PBD)[28] للكشف عن اختلال الصبغيات الصبغية المشتقة من الأمهات وكذلك عمليات الانتقال في البويضات. ميزة PBD مقارنةً ب PGD هي أنه يمكن إنجازه في فترة زمنية قصيرة. يتم تحقيق ذلك من خلال الحفر بالمنطقة zona drilling أو الحفر بالليزر laser drilling.[29]
خزعة قسيم أرومي
خزعة قسيم أرومي هي تقنية يتم فيها إزالة القسيم الأريمي من المنطقة الشفافة. يستخدم عادة للكشف عن اختلال الصيغة الصبغية.[30] يتم إجراء التحليل الجيني بمجرد اكتمال الإجراء. هناك حاجة لدراسات إضافية لتقييم المخاطر المرتبطة بهذا الإجراء.[31]
نمط الحياة / المخاطر البيئية
قد يؤدي تعرض الحيوانات المنوية لنمط الحياة والمخاطر البيئية و /أو المهنية إلى زيادة خطر اختلال الصيغة الصبغية. دخان السجائر هو معروف على أنه أحد عوامل تحفيز اختلال الصيغة الصبغية (aneugen). ويترافق مع زيادات في اختلال الصيغة الصبغية تتراوح من 1.5 إلى 3.0 أضعاف.[32][33] تشير دراسات أخرى إلى أن عوامل أخرى مثل استهلاك الكحول،[34] والتعرض المهني للبنزين،[35] والتعرض للمبيدات الحشرية فينفاليريت،[36] والكارباريل،[37] و البيسفينول A،[38] والمواد الكيميائية المسببة لاضطرابات الغدد الصماء أو الهرمونات الخارجية [39] واستخدام موانع الحمل الفموية والتعرض للإشعاع[39] أيضًا تزيد من احتمالية اختلال الصيغة الصبغية.
انظر أيضًا
- اختلال الصيغة الصبغية
- صيغة صبغية
- تعدد الصيغ الصبغية
- اضطرابات صبغية
- اختلالات وراثية عند الإنسان
- الجينات في متلازمة داون
- انقسام ميتوزي
- انقسام ميوزي
- كروماتيدات شقيقة
- كروموسوم متماثل
- كروماتيد
المراجع
- ^ Team, Almaany. "ترجمة و معنى nondisjunction بالعربي في قاموس المعاني. قاموس عربي انجليزي مصطلحات صفحة 1". www.almaany.com (بEnglish). Archived from the original on 2020-12-20. Retrieved 2020-12-20.
- ^ أ ب D. Peter (2006). Principles of genetics. Hoboken, NJ : Wiley. ISBN:978-0-471-69939-2. مؤرشف من الأصل في 2021-03-08.
- ^ أ ب ت ث Strachan، Tom؛ Read، Andrew (29 مارس 2018). "Human Molecular Genetics". DOI:10.4324/9780203833544. مؤرشف من الأصل في 2020-12-25.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ أ ب ت ث ج ح خ د Robert M.؛ Stanton، Bonita F.؛ St. Geme، Joseph W.؛ Schor، Nina F. (2011). Nelson Textbook of Pediatrics. Elsevier. ص. xxxiii. ISBN:978-1-4377-0755-7. مؤرشف من الأصل في 2020-12-23.
- ^ أ ب Ph.D, Katy McLaughlin (27 Oct 2016). "Nondisjunction". Biology Dictionary (بen-US). Archived from the original on 2019-08-09. Retrieved 2020-12-20.
{{استشهاد ويب}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ "Calvin Bridges Discovers Nondisjunction : History of Information". www.historyofinformation.com. مؤرشف من الأصل في 2020-12-20. اطلع عليه بتاريخ 2020-12-20.
- ^ "Calvin Bridges' Experiments on Nondisjunction as Evidence for the Chromosome Theory of Heredity (1913-1916) | The Embryo Project Encyclopedia". embryo.asu.edu. مؤرشف من الأصل في 2020-09-30. اطلع عليه بتاريخ 2020-12-20.
- ^ Ganetzky, Barry; Hawley, R. Scott (1 Jan 2016). "The Centenary of GENETICS: Bridges to the Future". Genetics (بEnglish). 202 (1): 15–23. DOI:10.1534/genetics.115.180182. ISSN:0016-6731. PMID:26733664. Archived from the original on 2019-04-29.
- ^ "The Metabolic and Molecular Bases of Inherited Disease, 8th Edition 2001". Journal of Inherited Metabolic Disease. ج. 24 ع. 4: 519–520. 2001-07. DOI:10.1023/a:1017409002434. ISSN:0141-8955. مؤرشف من الأصل في 23 ديسمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Quevedo، Oliver؛ García-Luis، Jonay؛ Matos-Perdomo، Emiliano؛ Aragón، Luis؛ Machín، Félix (16 فبراير 2012). "Nondisjunction of a Single Chromosome Leads to Breakage and Activation of DNA Damage Checkpoint in G2". PLoS Genetics. ج. 8 ع. 2. DOI:10.1371/journal.pgen.1002509. ISSN:1553-7390. PMID:22363215. مؤرشف من الأصل في 2017-03-09.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Vaahtokari، A.؛ Aberg، T.؛ Thesleff، I. (1996-01). "Apoptosis in the developing tooth: association with an embryonic signaling center and suppression by EGF and FGF-4". Development (Cambridge, England). ج. 122 ع. 1: 121–129. ISSN:0950-1991. PMID:8565823. مؤرشف من الأصل في 20 ديسمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Banks, Peter (1 Jan 1977). "Pulp changes after anterior mandibular subapical osteotomy in a primate model". Journal of Maxillofacial Surgery (بEnglish). 5: 39–48. DOI:10.1016/S0301-0503(77)80074-X. ISSN:0301-0503. Archived from the original on 2021-01-18.
- ^ Jones, Keith T.; Lane, Simon I. R. (15 Sep 2013). "Molecular causes of aneuploidy in mammalian eggs". Development (بEnglish). 140 (18): 3719–3730. DOI:10.1242/dev.090589. ISSN:0950-1991. PMID:23981655. Archived from the original on 2020-11-20.
- ^ Cahoon, Cori K.; Libuda, Diana E. (1 Sep 2019). "Leagues of their own: sexually dimorphic features of meiotic prophase I". Chromosoma (بEnglish). 128 (3): 199–214. DOI:10.1007/s00412-019-00692-x. ISSN:1432-0886. PMID:30826870. Archived from the original on 2021-03-17.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(help) - ^ "Sex Differences in Recombination in Sticklebacks" (PDF). مؤرشف من الأصل (PDF) في 2020-12-21.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ "The distribution of crossovers, and the measure of total recombination" (PDF). مؤرشف من الأصل (PDF) في 2020-12-21.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ Lenormand، Thomas؛ Dutheil، Julien (2005-3). "Recombination Difference between Sexes: A Role for Haploid Selection". PLoS Biology. ج. 3 ع. 3. DOI:10.1371/journal.pbio.0030063. ISSN:1544-9173. PMID:15736976. مؤرشف من الأصل في 21 ديسمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Jones, Keith T.; Lane, Simon I. R. (15 Sep 2013). "Molecular causes of aneuploidy in mammalian eggs". Development (بEnglish). 140 (18): 3719–3730. DOI:10.1242/dev.090589. ISSN:0950-1991. PMID:23981655. Archived from the original on 2020-11-20.
- ^ أ ب "Turner syndrome: MedlinePlus Genetics". medlineplus.gov (بEnglish). Archived from the original on 2020-11-19. Retrieved 2020-12-20.
- ^ أ ب ت ث H. William؛ Ballard، Roberta A.؛ Gleason، Christine A. (2005). Avery's Diseases of the Newborn. Elsevier. ص. xxii–xxiii. ISBN:978-0-7216-9347-7. مؤرشف من الأصل في 2020-12-27.
- ^ Koehler, Kara E.; Hawley, R. Scott; Sherman, Stephanie; Hassold, Terry (1 Sep 1996). "Recombination and nondisjunction in humans and flies". Human Molecular Genetics (بEnglish). 5 (Supplement_1): 1495–1504. DOI:10.1093/hmg/5.Supplement_1.1495. ISSN:0964-6906. Archived from the original on 2020-02-29.
- ^ Eichenlaub-Ritter, Ursula (29 Jan 2013). "Oocyte ageing and its cellular basis". International Journal of Developmental Biology (بEnglish). 56 (10-11-12): 841–852. DOI:10.1387/ijdb.120141ue. ISSN:0214-6282. PMID:23417406. Archived from the original on 2020-12-21.
- ^ Tartaglia، Nicole R؛ Howell، Susan؛ Sutherland، Ashley؛ Wilson، Rebecca؛ Wilson، Lennie (11 مايو 2010). "A review of trisomy X (47,XXX)". Orphanet Journal of Rare Diseases. ج. 5: 8. DOI:10.1186/1750-1172-5-8. ISSN:1750-1172. PMID:20459843. مؤرشف من الأصل في 2020-11-30.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب Team, Almaany. "ترجمة و معنى wild type بالعربي في قاموس المعاني. قاموس عربي انجليزي مصطلحات صفحة 1". www.almaany.com (بEnglish). Archived from the original on 2020-12-21. Retrieved 2020-12-21.
- ^ Harper، Peter S. (23 يناير 2002). "C.R. Scriver, A.L. Beaudet, W.S. Sly, D. Valle (eds.), B. Childs, K.W. Kinzler, B. Vogelstein (associate eds.): Molecular and metabolic bases of inherited disease, 8th edition". Human Genetics. ج. 110 ع. 2: 205–206. DOI:10.1007/s00439-001-0669-z. ISSN:0340-6717. مؤرشف من الأصل في 2018-06-02.
- ^ Harper، Joyce C.؛ Harton، Gary (2010-09). "The use of arrays in preimplantation genetic diagnosis and screening". Fertility and Sterility. ج. 94 ع. 4: 1173–1177. DOI:10.1016/j.fertnstert.2010.04.064. ISSN:1556-5653. PMID:20579641. مؤرشف من الأصل في 21 ديسمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ "Karyotyping: MedlinePlus Medical Encyclopedia". medlineplus.gov (بEnglish). Archived from the original on 2020-11-07. Retrieved 2020-12-20.
- ^ van der Ven، Katrin؛ Montag، Markus؛ van der Ven، Hans (2008-3). "Polar Body Diagnosis – A Step in the Right Direction?". Deutsches Ärzteblatt International. ج. 105 ع. 11: 190–196. DOI:10.3238/arztebl.2008.0190. ISSN:1866-0452. PMID:19629197. مؤرشف من الأصل في 20 ديسمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Montag، M.؛ van der Ven، K.؛ Rösing، B.؛ van der Ven، H. (2009). "Polar body biopsy: a viable alternative to preimplantation genetic diagnosis and screening". Reproductive Biomedicine Online. 18 Suppl 1: 6–11. DOI:10.1016/s1472-6483(10)60109-5. ISSN:1472-6491. PMID:19281658. مؤرشف من الأصل في 2020-12-20.
- ^ Parnes، Y. M. (1989-03). "RCT controversy". Journal of obstetric, gynecologic, and neonatal nursing: JOGNN. ج. 18 ع. 2: 90. DOI:10.1111/j.1552-6909.1989.tb00470.x. ISSN:0884-2175. PMID:2709181. مؤرشف من الأصل في 20 ديسمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Yu، Yang؛ Zhao، Yue؛ Li، Rong؛ Li، Li؛ Zhao، Hongcui؛ Li، Min؛ Sha، Jiahao؛ Zhou، Qi؛ Qiao، Jie (6 ديسمبر 2013). "Assessment of the risk of blastomere biopsy during preimplantation genetic diagnosis in a mouse model: reducing female ovary function with an increase in age by proteomics method". Journal of Proteome Research. ج. 12 ع. 12: 5475–5486. DOI:10.1021/pr400366j. ISSN:1535-3907. PMID:24156634. مؤرشف من الأصل في 2020-12-20.
- ^ Rubes، J.؛ Lowe، X.؛ Moore، D.؛ Perreault، S.؛ Slott، V.؛ Evenson، D.؛ Selevan، S. G.؛ Wyrobek، A. J. (1998-10). "Smoking cigarettes is associated with increased sperm disomy in teenage men". Fertility and Sterility. ج. 70 ع. 4: 715–723. DOI:10.1016/s0015-0282(98)00261-1. ISSN:0015-0282. PMID:9797104. مؤرشف من الأصل في 24 نوفمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Shi، Q.؛ Ko، E.؛ Barclay، L.؛ Hoang، T.؛ Rademaker، A.؛ Martin، R. (2001-08). "Cigarette smoking and aneuploidy in human sperm". Molecular Reproduction and Development. ج. 59 ع. 4: 417–421. DOI:10.1002/mrd.1048. ISSN:1040-452X. PMID:11468778. مؤرشف من الأصل في 20 أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Benassi-Evans، Bianca؛ Fenech، Michael (2011-05). "Chronic alcohol exposure induces genome damage measured using the cytokinesis-block micronucleus cytome assay and aneuploidy in human B lymphoblastoid cell lines". Mutagenesis. ج. 26 ع. 3: 421–429. DOI:10.1093/mutage/geq110. ISSN:1464-3804. PMID:21273273. مؤرشف من الأصل في 20 ديسمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ McHale، Cliona M.؛ Smith، Martyn T.؛ Zhang، Luoping (2014-3). "Application of toxicogenomic profiling to evaluate effects of benzene and formaldehyde: from yeast to human". Annals of the New York Academy of Sciences. ج. 1310 ع. 1: 74–83. DOI:10.1111/nyas.12382. ISSN:0077-8923. PMID:24571325. مؤرشف من الأصل في 6 نوفمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Xia، Yankai؛ Bian، Qian؛ Xu، Lichun؛ Cheng، Senping؛ Song، Lin؛ Liu، Jiayin؛ Wu، Wei؛ Wang، Shoulin؛ Wang، Xinru (15 أكتوبر 2004). "Genotoxic effects on human spermatozoa among pesticide factory workers exposed to fenvalerate". Toxicology. ج. 203 ع. 1–3: 49–60. DOI:10.1016/j.tox.2004.05.018. ISSN:0300-483X. PMID:15363581. مؤرشف من الأصل في 2020-11-17.
- ^ Xia، Yankai؛ Cheng، Senping؛ Bian، Qian؛ Xu، Lichun؛ Collins، Michael D.؛ Chang، Hebron C.؛ Song، Lin؛ Liu، Jiayin؛ Wang، Shoulin (2005-05). "Genotoxic effects on spermatozoa of carbaryl-exposed workers". Toxicological Sciences: An Official Journal of the Society of Toxicology. ج. 85 ع. 1: 615–623. DOI:10.1093/toxsci/kfi066. ISSN:1096-6080. PMID:15615886. مؤرشف من الأصل في 21 أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ "Bisphenol A Exposure Causes Meiotic Aneuploidy in the Female Mouse". Current Biology (بEnglish). 13 (7): 546–553. 1 Apr 2003. DOI:10.1016/S0960-9822(03)00189-1. ISSN:0960-9822. Archived from the original on 2012-12-05.
- ^ أ ب Nagaoka، So I.؛ Hassold، Terry J.؛ Hunt، Patricia A. (18 يونيو 2012). "Human aneuploidy: mechanisms and new insights into an age-old problem". Nature reviews. Genetics. ج. 13 ع. 7: 493–504. DOI:10.1038/nrg3245. ISSN:1471-0056. PMID:22705668. مؤرشف من الأصل في 2019-12-11.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)