|
تضامنًا مع حق الشعب الفلسطيني |
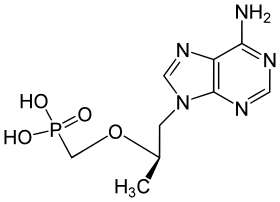
تينوفوفير
| تينوفوفير | |
|---|---|
| الاسم النظامي | |
| ({[(2R)-1-(6-amino-9H-purin-9-yl)propan-2-yl]oxy}methyl)phosphonic acid | |
| اعتبارات علاجية | |
| اسم تجاري | Viread |
| ASHPDrugs.com | أفرودة |
| مدلاين بلس | a602018 |
| فئة السلامة أثناء الحمل | B (الولايات المتحدة) |
| طرق إعطاء الدواء | فموي |
| بيانات دوائية | |
| توافر حيوي | 25% |
| ربط بروتيني | <1% |
| عمر النصف الحيوي | 17 ساعة |
| إخراج (فسلجة) | كلوي |
| معرّفات | |
| CAS | 147127-20-6 |
| ك ع ت | J05J05AF07 AF07 |
| بوب كيم | CID 464205 |
| درغ بنك | DB00300 |
| كيم سبايدر | 408154 |
| المكون الفريد | 99YXE507IL |
| كيوتو | D01982 |
| ChEMBL | CHEMBL483 |
| NIAID ChemDB | 080741 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C9H14N5O4P |
| الكتلة الجزيئية | 287.213 غ/مول |
| تعديل مصدري - تعديل | |
تينوفوفير/إمتريسيتابين (بالإنجليزية: tenofovir/emtricitabine) الاسم التجاري تروفادا (بالإنجليزية: Truvada) عقار توليفي (مشترك) بجرعة ثابتة يتألف من عقارين مضادين للفيروسات القهقرية يستخدمات في علاج متلازمة العوز المناعي المكتسب هما تينوفوفير بجرعة 300 مغ وإمتريسيتابين بجرعة 200 مغ. يؤدي خلط العقارين في قرص قرص واحد إلى التقليل من تعديد الأدوية وزيادة امتثال المريض للعلاج المضاد للفيروسات القهقرية. للدواء أثر وقائي أيضاً، حيث ثبتت فعاليته في اتقاء العدوى بفيروس العوز المناعي البشري عند غير المصابين به، وفي 10 مايو 2012 أوصت لجنة خبراء إدارة الأغذية والأدوية الأمريكية بترخيص تروفادا في الولايات المتحدة لدواعي اتقاء العدوى بفيروس الأيدز عند الأشخاص ذوي خطر إصابة مرتفع.[1] تأتي هذه التوصيات استناداً إلى ثلاث تجارب سريرية أثبتت أن للعقار مفعول واقٍ عند الذكور المثليين جنسياً والعائلات التي يكون أحد الشريكين مصاباً، وذلك بنسبة بين 44% إلى 75%.
للعقار عدد من الآثار الجانبية مثل الغثيان والإقياء والدوار وفقد الشهية والإسهال وسمية كلوية وكبدية ونقص كثافة العظام. كما أن الإمداد بالمتطلبات الشهرية لكل شخص يكلف 1200 دولار أمريكي، وهي تكلفة لا يتحملها أغلب المحتاجين إلى الدواء في البلدان النامية.
كما عبر عدد من الأطباء وناشطي مكافحة الأيدز عن قلقهم إزاء الاستعمال الوقائي للعقار مما يمكن أن يؤدي إلى تطور المقاومة الدوائية، وقد يعطي شعوراً كاذباً بالأمان لمستخدمي الدواء فيجعلهم يتركون الوسائل الوقائية الأخرى.[1]
أشكال الدواء
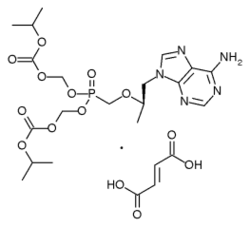
Tenofovir disoproxil fumarate هو دواء أولى شكل من تينوفوفير. Tenofovir يكون أيضا متوافر في صورة مركب وحيد الجرعة مع إمتريسيتابين في مركب ذو اسم تجارى تينوفوفير/إمتريسيتابين بجرعة وحيدة يومية. (Emtricitabine يسوق كمركب وحيد-الجرعة يدعى Emtriva, تسوقه أيضاGilead.) إمتريسيتابين/تينوفوفير/إيفافيرينز, مركب ثلاثى التركيب من تينوفوفير, emtricitabine و إيفافيرينز, أجيز بواسطة FDA في 12 يوليو 2006 وهو متوافر الآن مؤمنا جرعة واحدة يومية لعلاج HIV.
التاريخ
تينوفوفير أكتشف خلال بحوث مشتركة بين Antonín Holý في معهد الكيمياء العضوية والكيمياء الحيوية، و أكاديمية العلوم بجمهورية التشيك (IOCB) في پراغ, و Erik DeClercq, مؤسسة ريجا للبحوث الطبية , Catholic جامعةLeuven , بلجيكا.
تينوفوفير أجيز بالولايات هيئة الغذاء والدواء (FDA) في 26 أكتوبر, 2001 لعلاج فيروس نقص المناعة، وفي 11 أغسطس, 2008 لعلاج إلتهاب الكبدB المزمن.[2][3]
دواعى الاستعمال
Tenofovir يوصف بالإشتراك مع الأدوية الأخرى المضادة للفيروسات لعلاج عدوى HIV-1 في المرضى البالغين. وهذا الوصف مبنى على تحاليل البلازما HIV-1 RNA lمستويات و CD4 عدد خلاياin في دراسات تمت مراقبتها تينوفوفير في علاج-naïve و علاج-المرضى البالغين ذوى الخبرة. و لاتوجد نتائج لدراسات أثر التينوفوفير على التطور المرضى.
المراجع
- ^ أ ب "خبراء أمريكيون يؤيدون استخدام دواء «تروفادا» للوقاية من الايدز". بي بي سي عربي. 11 مايو 2012. مؤرشف من الأصل في 2012-06-21. اطلع عليه بتاريخ 2012-05-11.
- ^ FDA letter of approval (regarding treatment of hepatitis B)[وصلة مكسورة] نسخة محفوظة 25 فبراير 2009 على موقع واي باك مشين.
- ^ FDA Clears Viread for Hepatitis B نسخة محفوظة 08 نوفمبر 2012 على موقع واي باك مشين.
| في كومنز صور وملفات عن: تينوفوفير |