|
تضامنًا مع حق الشعب الفلسطيني |
بيروفات كايناز
تحتاج هذه المقالة كاملةً أو أجزاءً منها إلى تدقيق لغوي أو نحوي. (ديسمبر 2018) |
| بيروفات كايناز | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 3D structure of pyruvate kinase | |||||||||||
| أرقام التعريف | |||||||||||
| رقم التصنيف الإنزيمي | 2.7.1.40 | ||||||||||
| رقم التسجيل CAS | 9001-59-6 | ||||||||||
| قواعد البيانات | |||||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||||
| إكسباسي | راجع NiceZyme | ||||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||||
| ميتاسيك | المسار الأيضي | ||||||||||
| بريام | ملف التعريف | ||||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||||
| الأونتولوجيا الجينية | AmiGO / EGO | ||||||||||
| |||||||||||
البيروفات كايناز هو الإنزيم الذي يُحفز الخطوة الأخيرة من تحلل الجلوكوز. فإنه يحفز نقل مجموعة الفوسفات من الفسفوإينول بيروفات (PEP) إلى أدينوسين ثنائي الفوسفات (ADP)، مما يؤدي إلى إنتاج جزء واحد من البيروفات و جزء واحد من ATP.[1] يتواجد البيروفات كيناز في أربعة إيزوزيمات أو نظائر محددة الأنسجة، كل منها يتكون من الخصائص الحركية الخاصة اللازمة لاستيعاب الاختلافات في متطلبات التمثيل الغذائي للأنسجة المختلفة.
نظائر الإنزيم في الفقاريات
هناك أربعة نظائر لإنزيم البيروفات كايناز في الفقاريات: L (الكبد)، R (كريات الدم الحمراء)، M1 (العضلات، القلب والدماغ) M2 ( وهو شكل قابل للكشف فقط في مرحلة مبكرة للأنسجة الجنينية وموجودة أيضاً في معظم أنسجة البالغين). النظائر R و L كلاهما انزيمات أولستيرية وعكسية التنظيم على خلاف M1 و M2. من الناحية الحركيه للإنزيمات، النظائر R و L للبيروفات كايناز لديهم هيئتان؛ واحد لديه جاذبية مرتفعه للمادة الهدف والاخر لديه جاذبية منخفضة. R-state أو الحالة-R ، تتميز بالجاذبية العالية للمادة الهدف وتعتبر هي الشكل النشط لإنزيم البيروفات كايناز وهناك جزيئان يساعدان على التوازن والإستقرارلهذا الشكل وهما: (PEP) الفسفوإينول بيروفات و (FBP) فراكتوز ثنائي الفوسفات والذان بدورهما يؤديان إلى تعزيز مسار تحلل السكر أوالجلوكوز. T-الحالة (T-state)، تتميز بالجاذبية المنخفضة للمادة الهدف وتعتبر هي الشكل الغير فعال أوالغير نشط لإنزيم البيروفات كايناز، وهذا الشكل من الإنزيم يتطلب الارتباط ب أدينين ثلاثي الفوسفاتATP و الألانينalanine الذان بدورهما يساعدا الإنزيم على الاستقرار والتوازن، وبالتالي فسفرة البيروفات كايناز وتثبيط تحلل الجلوكوز.[2]
التعبيرالجيني لنظائرالانزيمات يختلف من نظير إلى آخر. فعلى سبيل المثال التعبير الجيني لنظائر البيروفات كاينازM1 و M2 ينظم عن طريق جين يسمى PKM بينما النظائر L و R تنظم عن طريق جين يسمى PKLR. من حيث الهيكل، إنزيم البيروفات كيناز لديه هيكلان أو شكلان: شكل ثنائي وشكل رباعي. بالنسبة للشكل الرباعي هو الشكل الخاص بالحالة- R للإنزيم والتي تتميز بالجاذبيه العالية ل PEP، على العكس للشكل الثنائي وهو الشكل الخاص بالحالة- T للإنزيم والتي تتميز بالجاذبية المنخفضة ل PEP. ونتيجة لذلك، التعبير الجيني يمكن أن ينظم عن طريق تحويل الشكل الرباعي النشط PKM2 (والذي ينتج عنه ارتفاع في تركيزPEP) إلى الشكل الثنائي الغير نشط الذي ينتج عنه تركيزمنخفض جدا ما يقارب الصفرمن PEP.[3]
نظائر الإنزيم في البكتيريا
العديد من البكتيريا المعوية، بما في ذلك القولونية (E.Coli)، لديها اثنان من الايزوفورم للبيروفات كايناز بمعنى أن هاذان الإنزيمان يختلفان في تسلسل الأحماض الأمينية ولكنهما يحفزان التفاعل الكيميائي نفسه، وهما PykA و PykF، في القولونية (E.Coli) هاذان الإنزيمان يتطابقان بنسبه 37% (Uniprot: PykA, PykF). وهما يحفزان نفس التفاعل كما هو الحال في حقيقيات النوى، وهي إنتاج الفسفوإينول بيروفات (PEP) و أدينوسين ثنائي الفوسفات ADP، والخطوة الأخيرة في تحلل الجلوكوز، وهذه الخطوة هي تفاعل غير عكوس أي لارجعة فيه في ظل الظروف الفسيولوجية. PykF هو إنزيم منظم فراغياً عن طريق الفركتوز ثنائي الفوسفات ( 1,6-bisphosphate (FBP الذي يعكس المكانة المركزية PykF في عملية الأيض الخلوية. عمليه النسخ ل PykF في E. coli ينظمه (Cra (FruR. في المقابل قد تبين أن MgATP يُثبط PfkB عند انخفاض تركيز Fru-6P، وهذا يلعب دوراً في تنظيم استحداث السكر أو بناء الجلوكوز.[4]
التفاعل
تحلل الجلوكوز
هناك نوعان من الخطوات في تفاعل البيروفات كيناز في تحلل الجلوكوز. أولاPEP ينقل مجموعة الفوسفات إلى ADP, لإنتاج ATP واينول البيروفات. ثانياً، يجب إضافة بروتون إلى اينول بيروفات لإنتاج الشكل الوظيفي أوالفعال من البيروفات والذي تحتاجه الخلية.[5]
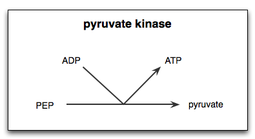
في خلايا الخميرة، تفاعل البيروفات كيناز للخميرة (YPK) مع PEP و المستجيب التفارغي الفركتوز ثنائي الفوسفات 1,6 (Fructose 1,6-bisphosphate (FBP وجد أن معدل هذا التفاعل يرتفع في وجود Mg2+. ولذلك عزل Mg2+ باعتباره عنصراً هاماً في نجاح تحفيز تحول PEP إلى البيروفات بواسطة البيروفات كايناز. وعلاوة على ذلك، فقد وجد أن أيونات معدن Mn2+ لها تأثير مماثل، ولكن تأثير أقوى على اقتران الطاقة الحرة ل YPK من Mg2+. ارتباط أيونات المعادن لمواقع ربط المعادن على كيناز البيروفات ترفع معدل تحويل PEP إلى البيروفات.[6]
التفاعل المحفز من قبل البيروفات كايناز هي الخطوة الأخيرة من تحلل الجلوكوز. وهي واحدة من الخطوات المؤثرة على معدل التفاعل. فإن الخطوات الثلاث التي تؤثر على معدل سلسله التفاعل في تحلل الجلوكوزهي أبطأ الخطوات في سلسلة التفاعلات وبالتالي تحدد معدل التفاعل الكلي. في تحلل الجلوكوز، الخطوات المؤثره على التفاعل مقترنه بتحلل جزيئ ATP أو فسفرة ADP و ذلك لإنتاج مكانيكية تفاعل غيرعكوس وعالي الطاقة. هذه الخطوة النهائية هي عالية التنظيم ولارجعة فيها عمداً لأن البيروفات هواللبنة المتوسطة الحاسمة لمزيد من الممرات الأيضية.[7] بمجرد بناء البيروفات عن طريق البيروفات كايناز فإن البيروفات إما أن تدخل في دورة السيتريك اسيد TCA لإنتاج المزيد من ATP تحت الظروف الهوائية أو يتم اختزالها إلى لاكتات تحت الظروف اللاهوائية. كل من هذه المسارات الأيضية الثانوية ضرورية في وظيفة التمثيل الغذائي.
بناء الجلوكوز: تفاعل عكسي
يعمل البيروفات كيناز أيضاً كإنزيم منظم لبناء السكر أو الجلوكوز، المسارالبيوكيميائية في الكبد الذي ينتج الجلوكوز من البيروفات ومواد أخرى. بناء السكر يستخدم مواد غير كربوهيدراتية لبناء الجلوكوز اللازم للمخ وخلايا الدم الحمراء في أوقات المجاعة عند نفاذ الجلوكوز المباشر.[8] أثناء الصيام, يقوم إنزيم البيروفات كاربوكسيلاس بفسفرة البيروفات كايناز، والذي بدوره يُعطل عمل الإنزيم وبالتالي يمنع الفسفوإينول بيروفات PEP من التحول إلى بيروفات. بدلاً من ذلك، الفسفوإينول بيروفات يتم تحويله إلى جلوكوز عن طريق سلسلة من التفاعلات لبناء الجلوكوز. على الرغم من أن عمليه بناء الجلوكوز يتم فيها استخدام انزيمات مشابهه للإينزيمات المستخدمه في تحلل الجلوكوز إلا أن تفاعلات البناء ليس عكس تفاعلات التحلل. بل هو بدلاً من ذلك المسار الذي يتحايل على الخطوات الغيرعكسية في تفاعلات التحلل. وعلاوة على ذلك، لا تحدث عملية بناء الجلوكوز وتحلله في وقت واحد في الخلية في أي لحظة معينة كما يتم تنظيم متبادل عن طريق إشارات الخلية. وبمجرد الانتهاء من مسار البناء للجلوكوز، يتم طرد الجلوكوز المنتج من الكبد، وتوفير الطاقة للأنسجة الحيوية في حالة الصيام.
التنظيم
تحلل الجلوكوز هو عملية عالية التنظيم في ثلاثة من الخطوات المحفزة التالية: فسفرة الجلوكوز هيكسوكيناز ، الفسفرة من الفركتوز-6-فوسفات عن طريق إنزيم فسفوفراكتوكايناز (phosphofructokinase) ونقل الفوسفات من فسفواينول بيروفاتPEP إلى ADP بواسطة البيروفات كايناز. تحت عدم وجود تغير جيني كل من هذه التفاعلات الثلاثة هي تفاعلات غير معكوسة ولا رجعة فيها، وتمتلك طاقة حرة سالبه كبيرة وأيضًا هي المسؤولة عن تنظيم هذا المسار. نشاط البيروفات كيناز منظم على نطاق واسع عن طريق المستجيبات التفارغية allosteric effectors, المعدلات التساهمية والتحكم الهرموني. و مع ذلك فإن أهم المنظمات للالبيروفات كيناز هومنظم الفركتوزثنائي الفوسفات-1,6-bisphosphate (FBP)، الذي يعمل كمستجيب تفارغي للانزيم.
المستجيبات التفارغيه
التنظيم التفارغي هو ارتباط المستجيب بموقع على البروتين الغير نشط، مما يتسبب في التغييرالتكويني وتغيير النشاط لذلك البروتين أوالإنزيم. وقد وجد أن البيروفات كيناز يتم تنشيطه تفارغيا عن طريق تكون ال FBP و يثبط نشاطه بواسطة ATP و ألانين.[9]
الفركتوزثنائي الفوسفات -1,6-(Fructose-1,6-bisphosphate)
FBP هو أهم مصدر من مصادر التنظيم لأنه يأتي من داخل مسار تحلل الجلوكوز. FBP هو السكر الوسيط الناتج من الفسفرة من الفركتوز 6-فوسفات. FBP يربط تفارغيا موقع ملزم على المجال C في البيروفات كايناز ويسبب تغير التشكل من الإنزيم، مما تسبب في تفعيل نشاط البيروفات كايناز. كوسيط موجود في المسار الجلوكوزي، FBP يوفرتفيز التغذية للامام feedforward و ذلك لانه بارتفاع تركيز FBP يكبر التنشيط التفارغي وحجم النشاط للبيروفات كايناز. البيروفات كيناز هو أكثر حساسية لآثار FBP. ونتيجة لذلك، فإن ما تبقى من الآليات التنظيمية بمثابة تعديلات ثانوية .[10]
المعدلات التساهمية
تعمل المعدلات التساهمية كمنظم غير مباشر وذلك من خلال التحكم في الفسفرة وإزالة الفسفرة من الإنزيمات، مما يؤدي إلى تفعيل وتثبيط النشاط الأنزيمي. في الكبد، الجلوكاجون وادرينالين يعمل كمعدلات تساهمية وذلك من خلال تفعيل بروتين كيناز الذي بدوره يفسفر ويعطل البيروفات كيناز. في المقابل، فإن إفراز الأنسولين استجابة لارتفاع سكر الدم ينشط الفسفوبروتين فوسفاتيز الفوسفاتيز، مما يتسبب في dephosphorylation وتفعيل البيروفات كينازI (phosphoprotein phosphatase I).و ينتج عن ذلك إزالة الفسفره وتنشيط البيروفات كايناز. هذا النظام التنظيمي هو المسؤول عن تجنب دورة عقيمة من خلال منع تفعيل البيروفات كايناز والإنزيمات التي تحفز بناء الجلوكوز في وقت واحد .[11]
الكربوهيدرات عنصر استجابة البروتين ملزمة (ChREBP)
ChREBP (Carbohydrate response element (binding protein هو بروتين أساسي في النسخ الجيني ل L isozyme للبيروفات كايناز. مجالات ChREBP هي مواقع مستهدفة لتنظيم البيروفات كايناز عن طريق الجلوكوز و cAMP. على وجه التحديد، ChREBP يتم تنشيطه من خلال ارتفاع نسبة الجلوكوز ويثبط عن طريق cAMP. الجلوكوز وcAMP يعملان بشكل معارض لبعضهما البغض من خلال التنظيم للمعدلات التساهمية . في حين يربط cAMP إلى Ser196 و Thr666 مواقع الربط في ChREBP ، و الذي يسبب الفسفرة وتثبيط البيروفات كايناز; الجلوكوز يربط Ser196 و Thr666 مواقع الربط في ChREBP، مما يتسبب في إزالة الفسفرة وتفعيل البيروفات كايناز. ونتيجة لذلك، cAMP والكربوهيدرات الزائدة تلعب دوراً غير مباشر في تنظيم البيروفات كايناز.[12]
التحكم الهرموني
من أجل منع دور الدورات غير المجدية، عمليه تحلل وبناء الجلوكوز هما عمليتان عالية التنظيم وذلك من أجل التأكد من أنهما لا تعملان في الخلية في نفس الوقت. ونتيجة لذلك، فإن تثبيط البيروفات كاينازعن طريق الجلوكاجون, cAMP و ادرينالين، ليس فقط لإيقاف تحلل الجلوكوز، ولكن أيضاً يُحفز عملية بناء السكر. يتداخل الأنسولين مع تأثير الجلوكاجون, cAMP و ادرينالين، مما يتسبب إلى العمل بشكل طبيعي للبيروفات كايناز وإيقاف بناء الجلوكوز. وعلاوة على ذلك، فقد وجد أن الجلوكوز يمنع ويعطيل بناء السكر، ويحفز تحلله. وعموماً، فإن التفاعل بين الهرمونات تلعب دوراً رئيسياً في عمل وتنظيم تحلل وبناء الجلوكوز في الخلية.[13]
اللتأثيرالمثبط للميتفورمين
الميتفورمين أو dimethylbiguanide هو العلاج الأساسي المستخدم لمرض السكري من النوع 2. قد ثبت أن الميتفورمين تُؤثر بشكل غير مباشرعلى البيروفات كيناز من خلال تثبيط بناء السكر. على وجه التحديد، يرتبط إضافة الميتفورمين بانخفاض ملحوظ في مستوى جريان الجلوكوز وزيادة في جريان اللاكتات/البيروفات من مختلف المسارات الأيضية. على الرغم من أن الميتفورمين لا تؤثر بشكل مباشر على نشاط البيروفات كايناز، فإنه يؤدي إلى انخفاض في تركيز ATP. و ذلك بسبب المستجيبات التفارغية المثبطة للATP على البيروفات كيناز. وبالتالي زيادة في نشاط البيروفات كايناز يوجه جريان التمثيل الغذائي إلى تحلل الجلوكوز بدلاً من بنائه.[14]
التطبيقات السريرية
نقص البيروفات كايناز
تسبب العيوب الوراثية من هذا الإنزيم المرض المعروف باسم نقص البيروفات كايناز. في حالة عدم وجود البيروفات كيناز يبطئ عملية تحلل الجلوكوز. هذا تأثير مدمر في الخلايا التي تفتقر إلى الميتوكوندريا ، لأن هذه الخلايا يجب ان تستخدم التحلل اللاهوائي كمصدر وحيد للطاقة لأن دورة السيتريك اسيد غير متوفرة. على سبيل المثال، في حالة نقص البيروفات كايناز،خلايا الدم الحمراء تصبح ناقصة بسرعه لل ATP و والذي بإمكانه أن يؤدي إلى انحلال الدم. ولذلك البيروفات كيناز يمكن أن يسبب نقص فقر الدم الانحلالي المزمن (CNSHA).[15]
PK-LR طفرة جينية
نقص البيروفات كايناز سببه اضطرابات جسمية متنحية. الثدييات لديهم جينان للبيروفات كايناز وهم, PK-LR (الذي يشفر عن نظائرالبيروفات كيناز L و R)
PK-M (الذي يشفر عن نظير البيروفات كايناز M1) ، ولكن فقط PKLR بترميز النظير الخاص بكريات الدم الحمراء والذي يؤثر على نقص البيروفات كايناز. أكثر من 250 PK-LR طفرات جينه التي تم تحديدها والتي ترتبط بنقص البيروفات كايناز. اختبار الحمض النووي وجهت اكتشاف موقع PKLR على كروموسوم 1 و تطوير اختبارات التسلسل الجيني المباشرفي التشخيص الجزيئي لنقص البيروفات كايناز.[16]
تطبيقات البيروفات كيناز المثبطة
أنواع الاكسجين التفاعلية (ROS) المثبطة
أنواع الاكسجين التفاعلية (ROS) كيميائيا أشكال نشطه من الأكسجين. في خلايا الرئة في الإنسان، قد تبين ان ROS تثبط نظير البيروفات كاينازM2. و ذلك عن طريق أكسدة Cys358 و تثبيط PKM2. نتيجة لتثبيط PKM2، توقف تحويل الجلوكوز إلى البيروفات، ولكن بدلاً من ذلك يستخدم في مسارالبتوز فوسفات pentose phosphate pathway ، مما أدى إلى خفض وإزالة سمومROS . و بالتالي، الآثار الضارة ل ROS ترتفع وتسبب زيادة الإجهاد التأكسدي في خلايا الرئة، مما يؤدي إلى إمكانية تشكيل الأورام. هذه الآلية المثبطة مهمة لأنها قد تشير إلى أن الآليات التنظيمية في PKM2 هي المسؤولة عن مساعدة الخلايا السرطانية مقاومة الاكسدة وتعزيز توموريجينيسيس.[17][18]
تثبيط الفنيل الأنين
يعمل الفينيل الأنين كمثبط تنافسي للبيروفات كايناز في الدماغ. على الرغم من أن درجة نشاط الفنيل الأنين المثبطة مماثل في كل من الجنين والكبار إلا أن الخلايا الإنزيمات في خلايا مخ الجنين أكثر عرضة بشكل كبير للتثبيط من خلايا الدماغ في الكبار. دراسة PKM2 في الأطفال الوراثية أمراض الدماغ phenylketonurics (PKU) ، أظهرت مستويات مرتفعة من الفنيل الأنين وانخفاض فعالية PKM2. توفر هذه الآلية المثبطة نظرة ثاقبة في دورالبيروفات كيناز في تلف الخلايا الدماغ.[19][20]

البدائل
عُثر على انزيم قابل للانعكاس مع وظيفة مماثلة، البيروفات الفوسفات ديكيناز (PPDK)، في بعض البكتيريا وتم نقلها إلى عدد من مجموعات الأوكساري اللاهوائي حقيقية النواة (على سبيل المثال، Streblomastix, Giardia, Entamoeba, and Trichomonas)، يبدو عن طريق نقل الجينات الأفقي في اثنين أو أكثر. في بعض الحالات، فإن نفس الكائن الحي يكون كل من كيناز البيروفات و PPDK.[21]
المراجع
- ^ Gupta, Vibhor; Bamezai, Rameshwar N.K. (1 Nov 2010). "Human pyruvate kinase M2: A multifunctional protein". Protein Science (بEnglish). 19 (11): 2031–2044. DOI:10.1002/pro.505. ISSN:1469-896X. PMID:20857498. Archived from the original on 2017-12-09.
- ^ Muirhead, Hilary (1 Apr 1990). "Isoenzymes of pyruvate kinase". Biochemical Society Transactions (بEnglish). 18 (2): 193–196. DOI:10.1042/bst0180193. ISSN:0300-5127. PMID:2379684. Archived from the original on 2018-07-25.
- ^ Eigenbrodt، E.؛ Reinacher، M.؛ Scheefers-Borchel، U.؛ Scheefers، H.؛ Friis، R. (1 يناير 1992). "Double role for pyruvate kinase type M2 in the expansion of phosphometabolite pools found in tumor cells". Critical Reviews in Oncogenesis. ج. 3 ع. 1–2: 91–115. ISSN:0893-9675. PMID:1532331.
- ^ Sabnis، N. A.؛ Yang، H.؛ Romeo، T. (8 ديسمبر 1995). "Pleiotropic regulation of central carbohydrate metabolism in Escherichia coli via the gene csrA". The Journal of Biological Chemistry. ج. 270 ع. 49: 29096–29104. ISSN:0021-9258. PMID:7493933.
- ^ Kumar, Saroj; Barth, Andreas (5 May 2010). "Phosphoenolpyruvate and Mg2+ Binding to Pyruvate Kinase Monitored by Infrared Spectroscopy". Biophysical Journal (بالإنجليزية). 98 (9): 1931–1940. DOI:10.1016/j.bpj.2009.12.4335. ISSN:0006-3495. PMID:20441757. Archived from the original on 2019-12-14.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (help) - ^ Bollenbach، Thomas J.؛ Nowak، Thomas (1 أكتوبر 2001). "Kinetic Linked-Function Analysis of the Multiligand Interactions on Mg2+-Activated Yeast Pyruvate Kinase". Biochemistry. ج. 40 ع. 43: 13097–13106. DOI:10.1021/bi010126o. ISSN:0006-2960. مؤرشف من الأصل في 2019-12-14.
- ^ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert; Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2002-01-01). Biochemistry (5th ed.). W H Freeman. (ردمك 0716730510). نسخة محفوظة 11 مارس 2014 على موقع واي باك مشين.
- ^ Berg JM, Tymoczko JL, Stryer L. Biochemistry. 5th edition.
- ^ Carbonell, Juan; Marco, Roberto; Felíu, Juan E.; Sols, Alberto (1 Aug 1973). "Pyruvate Kinase". European Journal of Biochemistry (بEnglish). 37 (1): 148–156. DOI:10.1111/j.1432-1033.1973.tb02969.x. ISSN:1432-1033. Archived from the original on 2017-12-09.
- ^ Jurica، Melissa S؛ Mesecar، Andrew؛ Heath، Patrick J؛ Shi، Wuxian؛ Nowak، Thomas؛ Stoddard، Barry L (15 فبراير 1998). "The allosteric regulation of pyruvate kinase by fructose-1,6-bisphosphate". Structure. ج. 6 ع. 2: 195–210. DOI:10.1016/S0969-2126(98)00021-5. مؤرشف من الأصل في 2018-12-08.
- ^ Birnbaum, M. J.; Fain, J. N. (25 Jan 1977). "Activation of protein kinase and glycogen phosphorylase in isolated rat liver cells by glucagon and catecholamines". Journal of Biological Chemistry (بEnglish). 252 (2): 528–535. ISSN:0021-9258. PMID:188818. Archived from the original on 2019-05-15.
- ^ Kawaguchi, Takumi; Takenoshita, Makoto; Kabashima, Tsutomu; Uyeda, Kosaku (20 Nov 2001). "Glucose and cAMP regulate the L-type pyruvate kinase gene by phosphorylation/dephosphorylation of the carbohydrate response element binding protein". Proceedings of the National Academy of Sciences (بEnglish). 98 (24): 13710–13715. DOI:10.1073/pnas.231370798. ISSN:0027-8424. PMID:11698644. Archived from the original on 2019-04-01.
- ^ Feliú, J. E.; Hue, L.; Hers, H. G. (1976-08-01).
- ^ Argaud، Doriane؛ Roth، Hubert؛ Wiernsperger، Nicolas؛ Leverve، Xavier M (1993). "Metformin decreases gluconeogenesis by enhancing the pyruvate kinase flux in isolated rat hepatocytes". European Journal of Biochemistry. ج. 213 ع. 3: 1341–1348. DOI:10.1111/j.1432-1033.1993.tb17886.x. مؤرشف من الأصل في 2017-07-31.
- ^ Grace، Rachael F.؛ Zanella، Alberto؛ Neufeld، Ellis J.؛ Morton، D. Holmes؛ Eber، Stefan؛ Yaish، Hassan؛ Glader، Bertil (1 سبتمبر 2015). "Erythrocyte pyruvate kinase deficiency: 2015 status report". American Journal of Hematology. ج. 90 ع. 9: 825–830. DOI:10.1002/ajh.24088. ISSN:1096-8652. PMID:26087744.
- ^ Climent، Fernando؛ Roset، Feliu؛ Repiso، Ada؛ Pérez de la Ossa، Pablo (1 يونيو 2009). "Red cell glycolytic enzyme disorders caused by mutations: an update". Cardiovascular & Hematological Disorders Drug Targets. ج. 9 ع. 2: 95–106. DOI:10.2174/187152909788488636. ISSN:2212-4063. PMID:19519368.
- ^ Anastasiou, Dimitrios; Poulogiannis, George; Asara, John M.; Boxer, Matthew B.; Jiang, Jian-kang; Shen, Min; Bellinger, Gary; Sasaki, Atsuo T.; Locasale, Jason W. (2 Dec 2011). "Inhibition of Pyruvate Kinase M2 by Reactive Oxygen Species Contributes to Cellular Antioxidant Responses". Science (بEnglish). 334 (6060): 1278–1283. DOI:10.1126/science.1211485. ISSN:0036-8075. PMID:22052977. Archived from the original on 2019-01-04.
- ^ Christofk، Heather R.؛ Heiden، Matthew G. Vander؛ Harris، Marian H.؛ Ramanathan، Arvind؛ Gerszten، Robert E.؛ Wei، Ru؛ Fleming، Mark D.؛ Schreiber، Stuart L.؛ Cantley، Lewis C. (مارس 2008). "The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth". Nature. ج. 452 ع. 7184: 230–233. DOI:10.1038/nature06734. PMID:18337823. مؤرشف من الأصل في 2019-12-14.
- ^ Miller, A. L.; Hawkins, R. A.; Veech, R. L. (2 Mar 1973). "Phenylketonuria: Phenylalanine Inhibits Brain Pyruvate Kinase in vivo". Science (بEnglish). 179 (4076): 904–906. DOI:10.1126/science.179.4076.904. ISSN:0036-8075. PMID:4734564. Archived from the original on 2018-06-03.
- ^ Weber, George (1 Aug 1969). "Inhibition of Human Brain Pyruvate Kinase and Hexokinase by Phenylalanine and Phenylpyruvate: Possible Relevance to Phenylketonuric Brain Damage". Proceedings of the National Academy of Sciences (بEnglish). 63 (4): 1365–1369. DOI:10.1073/pnas.63.4.1365. ISSN:0027-8424. PMID:5260939. Archived from the original on 2018-06-01.
- ^ Liapounova, Na؛ Hampl, V؛ Gordon, Pm؛ Sensen, Cw؛ Gedamu, L؛ Dacks, Jb (ديسمبر 2006)، "Reconstructing the mosaic glycolytic pathway of the anaerobic eukaryote Monocercomonoides"، Eukaryotic Cell، ج. 5، ص. 2138–46، DOI:10.1128/EC.00258-06، ISSN:1535-9778، PMID:17071828، مؤرشف من الأصل (Free full text) في 2019-12-14
وصلات خارجية
- Pyruvate+kinase في المكتبة الوطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
| بيروفات كايناز في المشاريع الشقيقة: | |