|
تضامنًا مع حق الشعب الفلسطيني |
المغازل العضلية
| المغازل العضلية | |
|---|---|
| تفاصيل | |
| تعديل مصدري - تعديل |
مغزل العضلات (بالإنجليزية: Muscle spindle) عبارة عن مستقبلات بداخل جسم العضلات تكشف بشكل أساسي التغيرات في طول العضلات. وتقوم بنقل معلومات الطول إلى الجهاز العصبي المركزي عن طريق الخلايا العصبية الحسية. يمكن معالجة هذه المعلومات من قبل الدماغ لتحديد موقف أجزاء الجسم. تلعب استجابات المغازل العضلية للتغيرات في الطول دورًا مهمًا في تنظيم انقباض العضلات، من خلال تنشيط الخلايا العصبية الحركية عبر منعكس الارتداد لمقاومة تمطيط العضلات.
هيكل
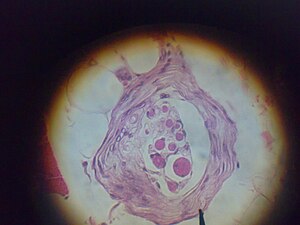
تم العثور على مغازل العضلات داخل بطن العضلات، بين ألياف العضلات وتُعرف الألياف المتخصصة التي تشكل المغزل العضلي باسم الألياف اللافية (كما هي موجودة داخل المغزل)، لتمييز نفسها عن ألياف العضلات نفسها التي تسمى ألياف خارجة عن النطاق. تحتوي المغزل العضلي على كبسولة من النسيج الضام، وتعمل بالتوازي مع الألياف العضلية (c).
تكوين
تتألف مغزل العضلات من ثلاثة إلى اثني عشر من ألياف العضلات، منها ثلاثة أنواع: ألياف كيس نووي ديناميكي (كيس 1 ألياف)، ألياف كيس نووي ثابت (كيس 2 ألياف)، ألياف سلسلة نووية وألياف عصبية واردة. الألياف الحلزونية حلزونية حول الألياف العضلية intrafusal ، وتنتهي بالقرب من منتصف كل ألياف. هذه الألياف، الألياف الحسية من النوع الأول Ia والألياف الحسية من النوع الثاني، ترسل المعلومات عن طريق القنوات الأيونية الحساسة للمحاور.
يتم توفير جزء المحرك من المغزل بواسطة الخلايا العصبية الحركية: ما يصل إلى عشرات الخلايا العصبية الحركية جاما وخلية عصبية واحدة أو اثنين من الخلايا العصبية بيتا، وتسمى مجتمعة fusimotor الخلايا العصبية. هذه تنشيط ألياف العضلات داخل المغزل. توفر الخلايا العصبية الحركية لجاما فقط ألياف العضلات داخل المغزل، في حين أن الخلايا العصبية الحركية بيتا توفر ألياف العضلات داخل وخارج المغزل. تنشيط الخلايا العصبية يسبب تقلص وتصلب الأجزاء الطرفية من ألياف العضلات المغزل العضلي.
يتم تصنيف الخلايا العصبية Fusimotor باعتبارها ثابتة أو ديناميكية وفقا لنوع الألياف العضلية التي يعصبون وتأثيرها على استجابات الخلايا العصبية Ia و II الحسية التي تعصب الجزء المركزي، غير متقلص من المغزل العضلي.
المحاور الاستاتيكية تعصب السلسلة أو كيس الألياف 2 . أنها تزيد من معدل إطلاق النار من affaents Ia و II في طول العضلات معين (انظر التخطيطي للعمل fusimotor أدناه). محاور عصبية ديناميكية يعصب كيس 1 الألياف العضلية intrafusal. أنها تزيد من الحساسية للامتداد من affaents Ia عن طريق تقوية 1 كيس intrafusal الألياف. وتنتهي أيضًا الألياف العصبية الفعالة لمضادات جاما العصبية في مغزل العضلات. أنها تجعل نقاط الاشتباك العصبي في أي من نهايات الألياف العضلية intrafusal وينظم حساسية afferents الحسية، التي تقع في المنطقة (غير الاستوائية) المركزية غير مقلص.[1][2]
الوظيفة
منعكس الامتداد
عندما تتمدد العضلة، تستجيب الألياف الأولية الحسية من النوع الأول للمغزل العضلي لكل من التغيرات في طول العضلات وسرعتها وتنقل هذا النشاط إلى الحبل الشوكي في شكل تغيرات في معدل جهد الفعل. وبالمثل، تستجيب الألياف الحسية الثانوية من النوع الثاني لتغيرات طول العضلات (ولكن مع مكون أصغر حساس للسرعة) وترسل هذه الإشارة إلى الحبل الشوكي. تنتقل الإشارات الواردة من Ia إلى العديد من الخلايا العصبية الحركية لألفا في العضلة المستقبلة الحاملة. ثم ينتقل النشاط المثير للانعكاس في المكورات العصبية ألفا عبر محاورهم العصوية إلى الألياف الخارجة عن الجسم من العضلات، والتي تولد القوة وبالتالي مقاومة التمدد. كما تنتقل الإشارة الوافدة Ia أيضًا عن طريق polysynaptically من خلال interneurons (Ia inhibitory interneurons)، والتي تمنع الخلايا العصبية alpha من العضلات المضادة، مما تسبب في الاسترخاء.
تعديل الحساسية
وظيفة الخلايا العصبية الحركية جاما ليست لتكملة قوة تقلص العضلات المقدمة من الألياف extrafusal ، ولكن لتعديل حساسية المغايرات الحسية المغزل العضلي لتمتد. عند إطلاق acetylcholine من قبل الخلايا العصبية الحركية النشيطة لأحجام جاما، فإن الأجزاء النهائية من الألياف العضلية intrafusal تتقلص، وبالتالي إطالة الأجزاء المركزية غير القابلة للانكماش (أنظر «عمل fusimotor» التخطيطي أدناه). هذا يفتح القنوات الأيونية الحساسة للتمدد للنهايات الحسية، مما يؤدي إلى تدفق أيونات الصوديوم. هذا يثير إمكانات الراحة للنهايات، مما يزيد من احتمالية إطلاق النار، مما يزيد من حساسية الشد العضلي المغزلي.
كيف يمكن للجهاز العصبي المركزي أن يتحكم في الخلايا العصبية الغاما fusimotor؟ كان من الصعب تسجيله من أشعة جاما العصبية أثناء الحركة الطبيعية لأن لديهم محاور عصبية صغيرة جدا. وقد اقترحت عدة نظريات، استنادا إلى تسجيلات من afferents المغزل.
1) Alpha-gamma activation. هنا يفترض أن يتم تنشيط motonurons جاما بالتوازي مع motonurons ألفا للحفاظ على إطلاق afferents المغزل عندما تقصير العضلات extrafusal.[3]
2) مجموعة Fusimotor: يتم تنشيط motoneurons غاما وفقا لحداثة أو صعوبة مهمة. في حين تنشط باستمرار نواتيات أشعة جاما الساكنة خلال الحركات الروتينية مثل الحركة، تميل المحركات الديناميكية لأشعة غاما إلى تنشيطها أثناء المهام الصعبة، مما يزيد من حساسية التمدد.
3) قالب Fusimotor من الحركة المقصودة. نشاط غاما الساكن هو «قالب زمني» للتقصير المتوقع وتطويل العضلة المستقبلة الحاملة. ينشط نشاط غاما الديناميكي بشكل مفاجئ، ويحفز عواطف المغزل على بداية تطويل العضلات والمغادرين من مسار الحركة المقصود.[4][5]
التطوير
ويعتقد أيضا أن المغازل العضلات تلعب دورا حاسما في تطوير الحواس.
الأهمية السريرية
بعد السكتة الدماغية أو إصابة الحبل الشوكي في البشر، غالباً ما يتطور فرط التوتر التشنجي (الشلل التشنجي)، حيث يكون رد الفعل الانعكاسي في العضلات المثنية للأذرع والعضلات الباسطة في الساقين مفرط الحساسية. هذا يؤدي إلى مواقف غير طبيعية، وتصلب والتقلصات. قد يكون Hypertonia نتيجة للحساسية المفرطة من motonurons ألفا و interneurons إلى إشارات و Ia و II.[6]
صور اضافية
-
العضلات المغزل
-
ألياف جاما
-
ألياف Ia
-
ألياف ألفا
-
رسم تخطيطي لعمل المحركات المغزلية
مراجع
- ^ Hulliger, Manuel (1984). Reviews of Physiology, Biochemistry and Pharmacology (بEnglish). Berlin, Heidelberg: Springer Berlin Heidelberg. pp. 1–110. DOI:10.1007/bfb0027694. ISBN:9783540136798. Archived from the original on 2018-10-09.
- ^ Hulliger، M. (1984). "The mammalian muscle spindle and its central control". Reviews of Physiology, Biochemistry and Pharmacology. ج. 101: 1–110. ISSN:0303-4240. PMID:6240757. مؤرشف من الأصل في 2018-10-09.
- ^ Vallbo، A. B.؛ al-Falahe، N. A. (1990-2). "Human muscle spindle response in a motor learning task". The Journal of Physiology. ج. 421: 553–568. ISSN:0022-3751. PMC:1190101. PMID:2140862. مؤرشف من الأصل في 2018-10-09.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة)صيانة الاستشهاد: تنسيق PMC (link) - ^ Taylor، A.؛ Durbaba، R.؛ Ellaway، P. H.؛ Rawlinson، S. (15 مارس 2006). "Static and dynamic gamma-motor output to ankle flexor muscles during locomotion in the decerebrate cat". The Journal of Physiology. ج. 571 ع. Pt 3: 711–723. DOI:10.1113/jphysiol.2005.101634. ISSN:0022-3751. PMC:1805796. PMID:16423858. مؤرشف من الأصل في 2018-10-09.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: تنسيق PMC (link) - ^ Taylor، A؛ Durbaba، R؛ Ellaway، P H؛ Rawlinson، S (15 مارس 2006). "Static and dynamic γ-motor output to ankle flexor muscles during locomotion in the decerebrate cat". The Journal of Physiology. ج. 571 ع. Pt 3: 711–723. DOI:10.1113/jphysiol.2005.101634. ISSN:0022-3751. PMC:1805796. PMID:16423858. مؤرشف من الأصل في 2020-01-11.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: تنسيق PMC (link) - ^ Heckmann، C. J.؛ Gorassini، Monica A.؛ Bennett، David J. (2005-2). "Persistent inward currents in motoneuron dendrites: implications for motor output". Muscle & Nerve. ج. 31 ع. 2: 135–156. DOI:10.1002/mus.20261. ISSN:0148-639X. PMID:15736297. مؤرشف من الأصل في 2018-10-09.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة)
| المغازل العضلية في المشاريع الشقيقة: | |



