|
تضامنًا مع حق الشعب الفلسطيني |
يوديد الألومنيوم
| يوديد الألومنيوم | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Aluminium iodide |
|
| أسماء أخرى | |
Aluminium(III) iodide Aluminum iodide |
|
| المعرفات | |
| رقم CAS | 7784-23-8 (anhydrate) 10090-53-6 (hexahydrate) |
| بوب كيم (PubChem) | 82222 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | AlI3 |
| الكتلة المولية | 407.69495 غ/مول (لامائي) 515.786 غ/مول (سداسي هيدرات) |
| المظهر | مسحوق أبيض في الحالة النقية العينات غير النقية تكون بنية |
| الكثافة | 3.98 غ/سم3 (لامائي) 2.63 غ/سم3 (سداسي هيدرات) |
| نقطة الانصهار | 189.4 °س، 463 °ك، 373 °ف |
| نقطة الغليان | 360 °س، 633 °ك، 680 °ف |
| الذوبانية في الماء | يتفاعل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
يوديد الألومنيوم مركب كيميائي له الصيغة AlI3، ويكون على شكل بلورات بيضاء في الحالة النقية.
التحضير
يحضر المركب من تفاعل الألومنيوم مع اليود:[1][2]
الخواص
يوجد المركب في الشروط القياسية على شكل صلب أبيض؛ وهو حساس للرطوبة ويتفكك بالتسخين إلى اليود وأكسيد الألومنيوم.
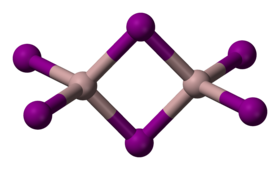
يتبلور المركب وفق نظام بلوري أحادي الميل، وهو يوجد عادة على شكل ثنائي وحدات. Al2I6.[3]
الاستخدامات
يستخدم المركب كاشفاً كيميائياً في فصم روابط معينة من C-O و N-O؛ كما يفصم إيثرات الأريل، كما ينزع الأكسجين من الإيبوكسيدات.[4]
المراجع
- ^ Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 876.
- ^ Watt، George W؛ Hall، James L؛ Taylor، William Lloyd؛ Kleinberg، Jacob (1953). "Aluminum Iodide". Inorganic Syntheses. Inorganic Syntheses. ج. 4. ص. 117–119. DOI:10.1002/9780470132357.ch39. ISBN:9780470132357.
- ^ John C. Bailar: Inorganic Syntheses. 1953, S. 118
- ^ Gugelchuk, M. (2004). "Aluminum Iodide". في L. Paquette (المحرر). Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons. DOI:10.1002/047084289X.ra083. ISBN:0471936235.
| في كومنز صور وملفات عن: يوديد الألومنيوم |