|
تضامنًا مع حق الشعب الفلسطيني |
سداسي ميثيلين رباعي الأمين
| سداسي ميثيلين رباعي الأمين | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
1,3,5,7-Tetraazatricyclo[3.3.1.13,7]decane |
|
| أسماء أخرى | |
Hexamine; Methenamine; |
|
| المعرفات | |
| رقم CAS | 100-97-0 |
| بوب كيم (PubChem) | 4101 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | C6H12N4 |
| الكتلة المولية | 140.186 g/mol |
| المظهر | White crystalline solid |
| الكثافة | 1.33 g/cm3 (at 20 °C) |
| نقطة الانصهار | 280 °س، 553 °ك، 536 °ف |
| الذوبانية في الماء | 85.3 g/100 mL |
| حموضة (pKa) | 4.89[1] |
| كود ATC | J01 |
| المخاطر | |
| مخاطر | Highly flammable, harmful |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
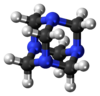
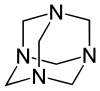
سداسي ميثيلين رباعي الأمين[2][2] هو مركب عضوي حلقي غير متجانس له الصيغة الكيميائية ، وهو شديد الذوبان في الماء والمذيبات العضوية القطبية. له بنية كيميائية شبيهه بالقفص مشابه للأدمانتان. وهو مفيد في تصنيع المركبات العضوية الأخرى بما في ذلك البلاستيك والمستحضرات الصيدلانية ومضافات المطاط. يتسامى في الفراغ عند 280 درجة مئوية.
التصنيع والبنية والتفاعل
اكتشف ألكسندر بتلروف سداسي ميثيلين رباعي الأمين عام 1859.[3][4] يتم تحضيره صناعيًا عن طريق الجمع بين الفورمالديهايد والأمونيا:[5]
يمكن إجراء التفاعل في الحالة الغازية وفي محلول.
المراجع
- ^ Cooney، A. P.؛ Crampton, M. R.؛ Golding, P. (1986). "The acid-base behaviour of hexamine and its N-acetyl derivatives". J. Chem. Soc., Perkin Trans. 2 ع. 6: 835. DOI:10.1039/P29860000835.
- ^ أ ب Q113378673، ص. 238، QID:Q113378673
- ^ Butlerow A (1859). "Ueber einige Derivate des Jodmethylens" [On some derivatives of methylene iodide]. Ann. Chem. Pharm. (بDeutsch). 111 (2): 242–252. DOI:10.1002/jlac.18591110219. Archived from the original on 2023-01-16. In this article, Butlerov discovered formaldehyde, which he called "dioxymethylen" (methylene dioxide) [page 247] because his empirical formula for it was incorrect (C4H4O4). On pages 249–250, he describes treating formaldehyde with ammonia gas, creating hexamine.
- ^ Butlerow A (1860). "Ueber ein neues Methylenderivat" [On a new methylene derivative]. Ann. Chem. Pharm. (بDeutsch). 115 (3): 322–327. DOI:10.1002/jlac.18601150325. Archived from the original on 2023-01-16.
- ^ Eller K، Henkes E، Rossbacher R، Höke H (2000). "Amines, Aliphatic". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH. DOI:10.1002/14356007.a02_001. ISBN:9783527306732.
| في كومنز صور وملفات عن: سداسي ميثيلين رباعي الأمين |

