|
تضامنًا مع حق الشعب الفلسطيني |
خلية جذعية مكونة للدم
| خلية جذعية مكونة للدم | |
|---|---|
| الاسم العلمي Cellula haematopoietica praecursoria |
|
مخطط لتكون الدم الطبيعي في الإنسان
| |
| تفاصيل | |
| تعديل مصدري - تعديل |
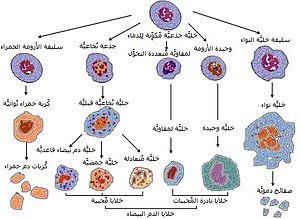
الخلية الجذعية المكونة للدم[1] (بالإنجليزية: Hematopoietic Stem Cell) هي خلية جذعية بالغة لها القدرة على التمايز إلى جميع أنواع خلايا الدم (خلايا حمراء وخلايا بيضاء بجميع أنواعها وصفائح دموية).[2][3] يتم الحصول على هذه الخلية من نخاع العظم وتأخذ عادة من عظم الفخذ أو عظمة القص.
تكون الدم هو العملية التي تنضج بها خلايا الدم التي ينتجها نخاع العظام. يجب أن يسد نخاع العظام احتياجات هائلة (ينتج الفرج في المتوسط نحو 500 مليار خلية دم كل يوم) مع الاحتياج لتنظيم عدد كل نوع من أنواع خلايا الدم في الدورة الدموية. يتكون الدم في الفقاريات في نخاع العظام، وتُشتق الخلايا من عدد محدود من الخلايا الجذعية عديدة الإمكانات، القادرة على التجدد بصورة هائلة.
تتمايز الخلايا الجذعية المكونة للدم إلى العديد من أنواع الخلايا في الدم، في خطوط إنتاج تُعرف باسم تكون النقويات وتكون اللمفاويات. خط النقويات وخط اللمفاويات كلاهما معنيّ بتكوين الخلايا المتغصنة. تشمل النقويات الخلية الوحيدة والخلايا البلعمية الكبيرة والخلايا الحبيبية المتعادلة والخلية القاعدية والخلية الحمضية وكريات الدم الحمراء وخلية نواء تتحول إلى الصفائح الدموية. تشمل الخلايا اللمفاوية الخلايا التائية والخلايا البائية والخلايا الفاتكة الطبيعية. تطور تعريف الخلايا الجذعية المكونة للدم منذ اكتشافها لأول مرة في عام 1961. يحتوي النسيج الجذعي الدموي على خلايا لها قدرة طويلة الأمد على التجدد وأخرى لها قدرة قصيرة الأمد على التجدد، وأسلاف عديدة الإمكانات وقليلة الإمكانات وذات إمكانية وحيدة. تكون الخلايا الجذعية المكونة للدم نحو 1:10000 من الخلايا في نسيج النقويات.
تُستخدم الخلايا الجذعية المكونة للدم في علاج بعض السرطانات وأمراض المناعة.[4]
التركيب
هي خلايا مدورة غير متلاصقة، ولها نواة مدورة، ونسبة السيتوبلازم إلى النواة قليلة. تشبه الخلايا الجذعية المكونة للدم الخلايا اللمفاوية شكلاً.
الموقع
توجد الخلايا الجذعية المكونة للدم في نخاع العظام عند البالغين، خاصة في الحوض وعظم الفخذ وعظمة القص. وتوجد في الحبل السري وبأعداد قليلة في الدم.[5]
يمكن الحصول على الخلايا الجذعية والمولدة من الحوض، عند العرف الحرقفي، باستخدام إبرة ومحقن.[6] يمكن إزالة الخلايا في صورة سائلة (لإجراء فحص لمورفولوجيا الخلية تحت الميكروسكوب) أو يمكن الحصول عليها في صورة خزعة (للحفاظ على بنية النسيج أو علاقة الخلية بغيرها من الخلايا).
الأنواع الفرعية
وحدة تكوين المستعمرة هي نوع فرعي من الخلايا الجذعية المكونة للدم. (يختلف هذا المعنى عن وحدات عد المستعمرات الخاصة بالميكروبات، فهي وحدة خاصة بالعد.) توجد العديد من أنواع الخلايا الجذعية المكونة للمستعمرات:
- وحدة تكوين مستعمرات كرية حمراء-خلية وحيدة- خلية نواء-خلية محببة
- وحدة تكوين مستعمرات خلية لمفاوية
- وحدة تكوين مستعمرات كرية حمراء
- وحدة تكوين مستعمرات خلية محببة-خلية أكولة
- وحدة تكوين مستعمرات خلية نواء
- وحدة تكوين مستعمرات خلية قاعدية
- وحدة تكوين مستعمرات خلية حمضية
تُبنى الوحدات المذكورة على خطوط الإنتاج. تمثل وحدة تكوين المستعمرات في الطحال عملية تكوين مستعمرة مستنسخة في الجسم الحي، وتعتمد على قدرة خلايا نخاع العظام المنقول على تكوين خلايا دم ناضجة في طحال الفئران المتعرضة للإشعاع بعد 8 إلى 12 يوم. استُخدمت تلك الوحدات كثيراً في الدراسات المبكرة، ولكنها تُستخدم حالياً لقياس خلايا أولية أكثر نضجاً أو الخلايا مؤقتة التكبير بدلاً من الخلايا الجذعية.
عزل الخلايا الجذعية
لا يمكن عزل الخلايا الجذعية المكونة للدم بصورة نقية، وبالتالي لا يمكن رؤيتها بمفردها تحت الميكروسكوب. يمكن التعرف على الخلايا الجذعية المكونة للدم أو عزلها باستخدام قياس التدفق الخلوي، إذ تدمج واسمات أسطح الخلايا العديدة المختلفة (خاصة CD34) وتُستخدم لفصل الخلايا الجذعية النادرة المكونة للدم من خلايا الدم المحيطة بها. تفتقر الخلايا الجذعية المكونة للدم لتعبير واسمات الخلايا الناضجة. يُستخدم الافتقار لتعبير واسمات خطوط الإنتاج بالإضافة إلى تمييز سطح الخلية الإيجابي لعزل خلايا الدم الجذعية. تتميز الخلايا الجذعية المكونة للدم أيضاً بحجمها الصغير وشح صبغها بالأصباغ الحيوية مثل الرودامين 123 وهويتشست 33342.
الوظيفة
تكون الدم
وظيفة الخلايا الجذعية المكونة للدم تكوين خلايا الدم. يمكن للخلايا الجذعية أن تكوِّن كل أنواع خلايا الدم (تعدد الإمكانيات) ولها قدرة على التجدد. يتمدد عدد صغير من الخلايا الجذعية المكونة للدم لإنتاج عدد كبير من خلايا الدم الجذعية الوليدة. تُستخدم تلك الظاهرة في عملية زرع نخاع العظام، عندما يعيد عدد صغير من الخلايا الجذعية المكونة للدم تشكيل جهاز الخلايا الجذعية. تشير تلك العملية إلى أن انقسام الخلايا المتناظر هو أحد التوابع الضرورية لعملية زرع نخاع العظام.[7]
يُعتقد أن تجدد الخلايا الجذعية يحدث في مشكاة الخلايا الجذعية في نخاع العظام، ومن المعقول افتراض وجود مؤشرات ضرورية في هذه المشكاة للتجدد الذاتي. يُلقى الضوء على المتطلبات البيئية والجزيئية للتجدد الذاتي للخلايا الجذعية المكونة للدم، لأن فهم قدرة الخلايا الجذعية على تجديد نفسها سيتيح في النهاية توسيع عددها خارج جسم الكائن الحي لاستخدامها علاجياً.
الخمول
مثلها مثل كل الخلايا الجذعية البالغة، توجد الخلايا الجذعية المكونة للدم في حالة خمول أو توقف نمو قابل للتغيير. يساعد تغير أيض الخلايا الجذعية المكونة للدم الخاملة في نجاة الخلية لمدة طويلة من الزمن في بيئة نخاع العظام شحيحة الأكسجين.[8] عندما تُثار تلك الخلايا بموت الخلية أو تلفها، تغادر الخلايا الجذعية الحالة الخاملة وتبدأ في النشاط الانقسامي مجددًا.[9]
الحركة
للخلايا الجذعية المكونة للدم قدرة غير موجودة في خلايا الدم غير الناضجة الأخرى، إذ تستطيع الفرار من حاجز نخاع العظام والتنقل في الدم والانتقال من إحدى العظام لأخرى. وإذا استقرت الخلية في الغدة الزعترية، فربما تتطور إلى خلايا تائية. ربما تستقر الخلايا الجذعية المكونة للدم في الكبد أو الطحال وتتطور في حالة الأجنة وتكون الدم خارج نخاع العظام.
يمكّن ذلك العلماء من الاستفادة من تلك الخلايا الجذعية وزرعها مباشرة من الدم.
تلف الحمض النووي (الدنا) عند الشيخوخة
تتراكم كسور شريط الدنا على المدى الطويل أثناء شيخوخة الخلايا الجذعية المكونة للدم. يرتبط هذا التراكم بإضعاف واسع لعملية إصلاح الدنا ومسار الاستجابة المعتمد على خمول الخلايا الجذعية المكونة للدم.[10] يُعتبر ربط النهايات غير المتناظرة إحدى مسارات إصلاح اللولب المزدوج للدنا. يُشار إليها بصفة «اللاتناظر» لأن نهايات الكسر تُربط معاً مباشرة دون الحاجة لقطعة مناظرة. يعتمد هذا المسار على العديد من البروتينات مثل ليغيز 4 ودنا بوليميريز مو وعامل 1 لمسار ربط النهايات غير المتناظرة.
يتميز إنزيم دنا ليغيز 4 بدور محدد للغاية في عملية إصلاح شريط الدنا المزدوج في مسار ربط النهايات غير المتناظرة. يؤدي غياب ليغيز 4 في الفئران إلى فقدان متزايد للخلايا الجذعية المكونة للدم أثناء الشيخوخة. يؤدي نقص ليغيز 4 في الخلايا متعددة الإمكانات إلى تراكم كسور اللولب المزدوج للدنا ويحفز انتحار الخلية.[11]
في حالة الفئران ذات الطفرة في جينات إنزيم بوليميريز مو، يختل نمو الخلايا الجذعية المكونة للدم في العديد من التجمعات الخلوية الطرفية في نخاع العظام، ويؤدي لنقص يصل إلى 40% في عدد خلايا نخاع العظام التي تشمل خطوط الإنتاج المختلفة المكونة للدم. تقل قدرة التوسع لدى الخلايا الجذعية الأولية. ترتبط تلك السمات بنقص القدرة على إصلاح كسور اللولب المزدوج في نسيج الخلايا الجذعية المكونة للدم.[12]
مراجع
- ^ Q118929029، ص. 399، QID:Q118929029
- ^ Sieburg HB، Muller-Sieburg CE (2004). "Classification of short kinetics by shape". In Silico Biol. ج. 4 ع. 2: 209–17. PMID:15107024.
- ^ Nijnik A، Woodbine L، Marchetti C، Dawson S، Lambe T، Liu C، Rodrigues NP، Crockford TL، Cabuy E، Vindigni A، Enver T، Bell JI، Slijepcevic P، Goodnow CC، Jeggo PA، Cornall RJ (2007). "DNA repair is limiting for haematopoietic stem cells during ageing". Nature. ج. 447 ع. 7145: 686–90. Bibcode:2007Natur.447..686N. DOI:10.1038/nature05875. PMID:17554302.
- ^ Rossi DJ، Bryder D، Seita J، Nussenzweig A، Hoeijmakers J، Weissman IL (2007). "Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age". Nature. ج. 447 ع. 7145: 725–9. Bibcode:2007Natur.447..725R. DOI:10.1038/nature05862. PMID:17554309.
- ^ "Cord Blood 2.0: Umbilical Cord Stem Cell Banking - Americord". cordadvantage.com. مؤرشف من الأصل في 2017-11-12.
- ^ "Bone Marrow Transplant Process". Mayo Clinic. مؤرشف من الأصل في 2016-10-10. اطلع عليه بتاريخ 2015-03-18.
- ^ Mahla RS (2016). "Stem Cells Applications in Regenerative Medicine and Disease Therapeutics". International Journal of Cell Biology. ج. 2016 ع. 7: 6940283. DOI:10.1155/2016/6940283. PMC:4969512. PMID:27516776.
- ^ Srikanth L، Sunitha MM، Venkatesh K، Kumar PS، Chandrasekhar C، Vengamma B، Sarma PV (2015). "Anaerobic Glycolysis and HIF1α Expression in Haematopoietic Stem Cells Explains Its Quiescence Nature". Journal of Stem Cells. ج. 10 ع. 2: 97–106. PMID:27125138.
- ^ Baumgartner C، Toifl S، Farlik M، Halbritter F، Scheicher R، Fischer I، Sexl V، Bock C، Baccarini M (يونيو 2018). "An ERK-Dependent Feedback Mechanism Prevents Hematopoietic Stem Cell Exhaustion". Cell Stem Cell. ج. 22 ع. 6: 879–892.e6. DOI:10.1016/j.stem.2018.05.003. PMC:5988582. PMID:29804890.
- ^ Beerman I، Seita J، Inlay MA، Weissman IL، Rossi DJ (يوليو 2014). "Quiescent hematopoietic stem cells accumulate DNA damage during aging that is repaired upon entry into cell cycle". Cell Stem Cell. ج. 15 ع. 1: 37–50. DOI:10.1016/j.stem.2014.04.016. PMC:4082747. PMID:24813857.
- ^ Tilgner K، Neganova I، Moreno-Gimeno I، Al-Aama JY، Burks D، Yung S، Singhapol C، Saretzki G، Evans J، Gorbunova V، Gennery A، Przyborski S، Stojkovic M، Armstrong L، Jeggo P، Lako M (أغسطس 2013). "A human iPSC model of Ligase IV deficiency reveals an important role for NHEJ-mediated-DSB repair in the survival and genomic stability of induced pluripotent stem cells and emerging haematopoietic progenitors". Cell Death and Differentiation. ج. 20 ع. 8: 1089–100. DOI:10.1038/cdd.2013.44. PMC:3705601. PMID:23722522.
- ^ Tilgner K، Neganova I، Singhapol C، Saretzki G، Al-Aama JY، Evans J، Gorbunova V، Gennery A، Przyborski S، Stojkovic M، Armstrong L، Jeggo P، Lako M (سبتمبر 2013). "Brief report: a human induced pluripotent stem cell model of cernunnos deficiency reveals an important role for XLF in the survival of the primitive hematopoietic progenitors". Stem Cells. ج. 31 ع. 9: 2015–23. DOI:10.1002/stem.1456. PMID:23818183.
| في كومنز صور وملفات عن: خلية جذعية مكونة للدم |
